糖尿病(Diabetes mellitus)是一种以高血糖为特征的代谢性疾病,而胰岛素是目前治疗糖尿病的最主要药物之一。胰岛素作为一种蛋白质药物,在生产、储存或皮下注射时,胰岛素很容易发生错误聚集而丧失活性;另外,经皮下注射进入体内的胰岛素很容易被蛋白酶水解,从而影响治疗效果。热休克蛋白作为一类天然分子伴侣,是维持体内蛋白稳态的重要物质,其疏水空腔可以与蛋白质相互作用,不仅能有效控制蛋白质的错误折叠与聚集,而且可以辅助蛋白质的折叠、转运和清除,从而保证细胞的正常生理功能。
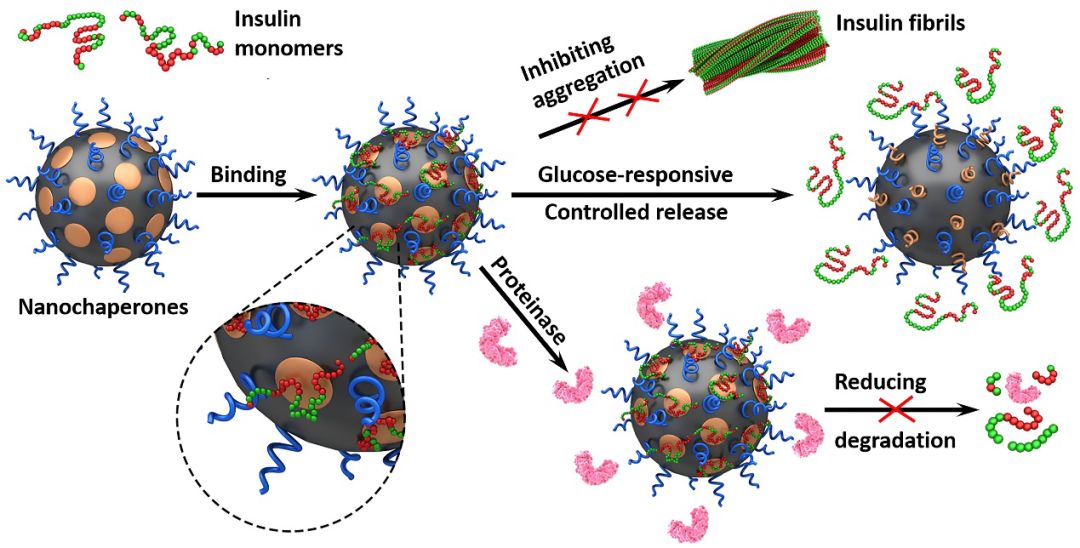
图1. 纳米分子伴侣负载和保护胰岛素单体,抑制其错误聚集,减弱其被蛋白酶降解的程度,葡萄糖响应性释放胰岛素的示意图
近日,南开大学化学学院史林启教授和马如江副研究员在美国化学会学术期刊Nano Letters(DOI: 10.1021/acs.nanolett.9b04966)上发表了研究论文,利用混合壳层胶束模拟热休克蛋白的结构和功能,构建新型纳米分子伴侣(Nanochaperones),用于介导胰岛素投递。该纳米分子伴侣的表面由塌缩的葡萄糖响应性疏水微区与伸展的亲水聚合物链段组成,形成类似热休克蛋白的疏水空腔,有效负载和保护胰岛素,抑制其错误聚集和被蛋白酶降解,从而实现高效递送和葡萄糖响应性释放胰岛素(图1)。
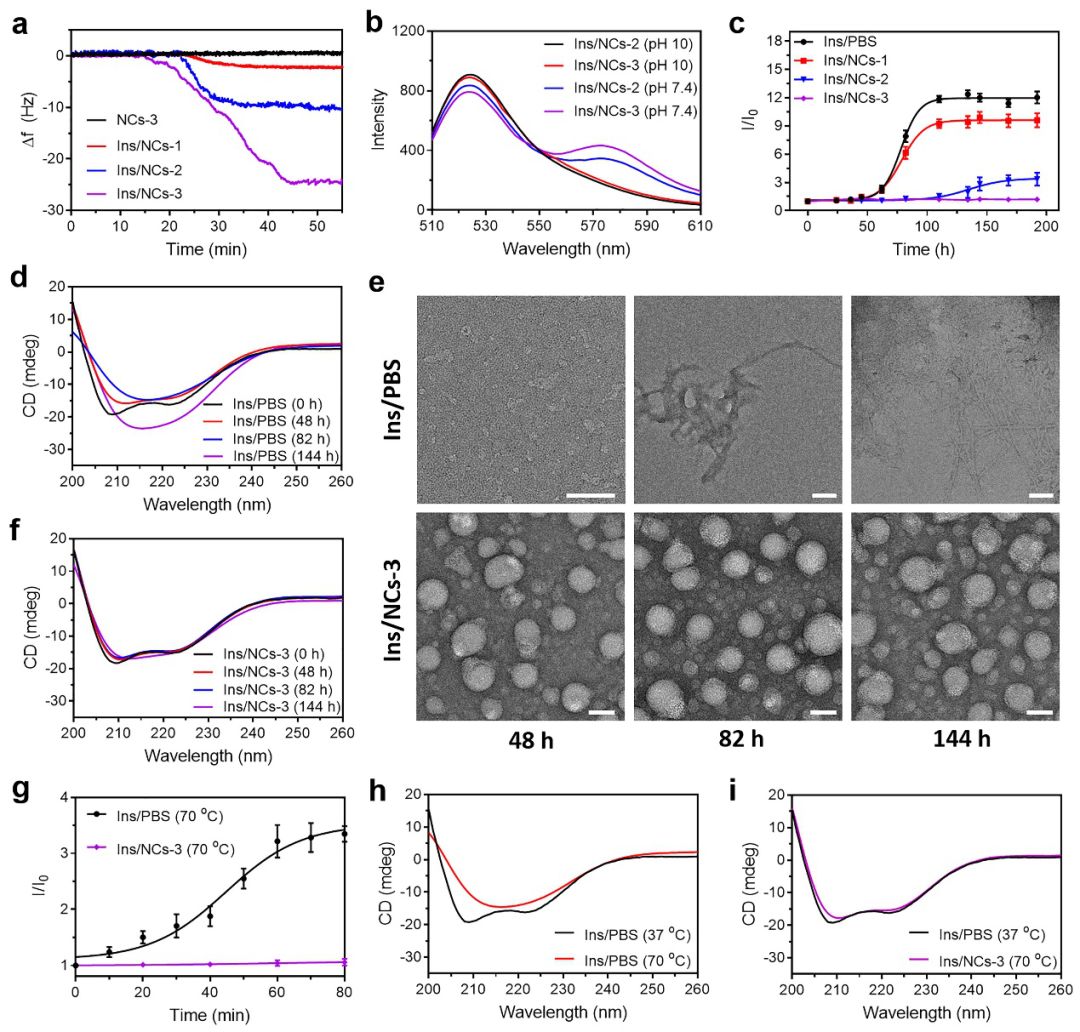
图1. 纳米分子伴侣负载和保护胰岛素单体,抑制其错误聚集,减弱其被蛋白酶降解的程度,葡萄糖响应性释放胰岛素的示意图
近日,南开大学化学学院史林启教授和马如江副研究员在美国化学会学术期刊Nano Letters(DOI: 10.1021/acs.nanolett.9b04966)上发表了研究论文,利用混合壳层胶束模拟热休克蛋白的结构和功能,构建新型纳米分子伴侣(Nanochaperones),用于介导胰岛素投递。该纳米分子伴侣的表面由塌缩的葡萄糖响应性疏水微区与伸展的亲水聚合物链段组成,形成类似热休克蛋白的疏水空腔,有效负载和保护胰岛素,抑制其错误聚集和被蛋白酶降解,从而实现高效递送和葡萄糖响应性释放胰岛素(图1)。
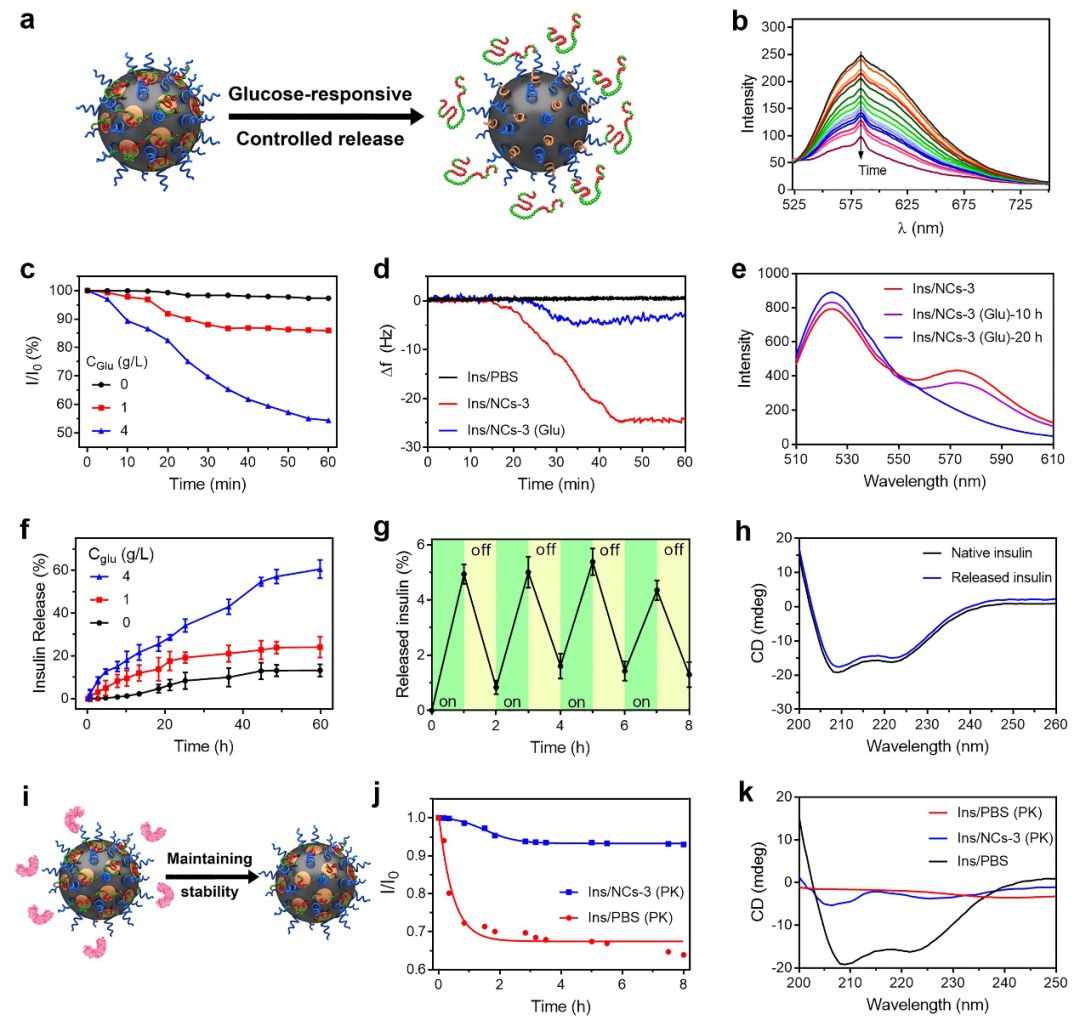
图3. (a) 纳米分子伴侣葡萄糖响应性释放胰岛素的示意图,(b-c) 茜素红S荧光测试图,(d) 石英晶体微天平测试图,(e) 荧光共振能量转移图,(f-g) 葡萄糖响应性释放胰岛素结果图,(h, k) 圆二色光谱图,(i) 纳米分子伴侣减弱胰岛素被蛋白酶降解程度的示意图,(j) 8-苯胺萘磺酸荧光测试图
接下来,研究人员在体外考察了纳米分子伴侣响应性释放以及抑制胰岛素被蛋白酶降解的能力。茜素红S(ARS)荧光测试、QCM、FRET和葡萄糖响应性释放胰岛素的实验结果表明,纳米分子伴侣通过与葡萄糖作用,疏水微区的聚合物链可响应性伸展出来,从而有效释放出预先负载的胰岛素(图3a-h)。同时,8-苯胺萘磺酸(ANS)荧光测试和CD实验结果均证明,纳米分子伴侣可有效保护胰岛素,有效抑制其被蛋白酶降解(图3i-j)。
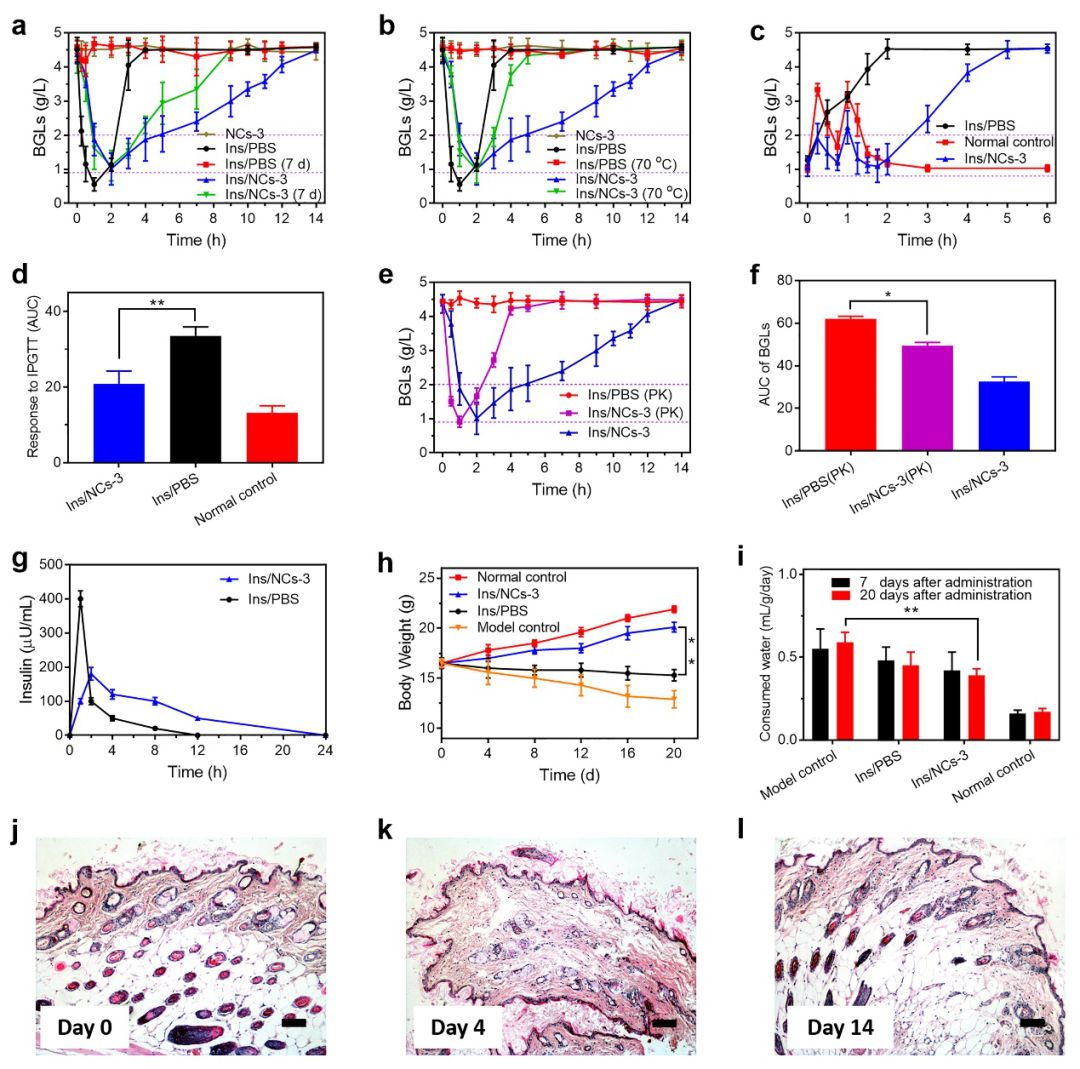
图4. (a-b, e-f) 负载胰岛素的纳米分子伴侣的体内疗效实验结果图,(c-d) 葡萄糖耐受实验结果图,(g) 血清胰岛素含量测试图,(h-i) 模型动物体重和饮水量变化图,(j-l) 糖尿病模型小鼠的皮下组织切片图
体内实验的结果进一步证实了纳米分子伴侣的体内胰岛素投递效果。体内降血糖实验结果表明,纳米分子伴侣可有效提高胰岛素的体内循环时间,获得较长时间的降血糖效果。在纳米分子伴侣保护下,胰岛素在37℃孵育7天或70℃孵育1小时后仍具有明显的降血糖效果。另外,负载有胰岛素的纳米分子伴侣与蛋白酶共孵育后,其也具有一定的降血糖效果(图4a-b, e-f)。葡萄糖耐受实验结果表明,负载有胰岛素的纳米分子伴侣具有明显的体内葡萄糖响应性(图4c-d)。利用纳米分子伴侣负载胰岛素对糖尿病模型小鼠进行持续治疗,其体重和饮水量均呈现积极变化(图4g-i)。此外,纳米分子伴侣良好的生物相容性也得到了验证(图4j-l)。
以上体外/体内实验的结果均表明,基于混合壳层复合胶束的纳米分子伴侣可以有效抑制胰岛素聚集,显著降低胰岛素被体内蛋白酶降解的程度,高效递送并根据体内血糖变化释放胰岛素,从而有效调控糖尿病模型小鼠的血糖水平。因此,该纳米分子伴侣有望为糖尿病的治疗提供新的策略和思路。
论文的第一作者为南开大学化学学院李畅博士,目前在同济大学杜建忠教授课题组从事博士后研究;南开大学化学学院史林启教授和马如江副研究员为论文共同通讯作者。
论文链接:
https://pubs.acs.org/doi/10.1021/acs.nanolett.9b04966




