乏氧是多数实体肿瘤的常见特征,主要是因为肿瘤快速增殖引起的耗氧量增加和肿瘤脉管系统改变导致的供氧不足。肿瘤的乏氧特性以及随之而来的高度还原性环境,为肿瘤选择性成像及靶向治疗提供了重要靶点。目前常见的乏氧靶向药物递送策略包括:(1)共价前药,将抗肿瘤药物与乏氧响应基团——如硝基、醌、偶氮等共价相连形成前药,在乏氧环境下,响应基团被生物还原酶还原,释放药物;(2)纳米载药体系,将抗肿瘤药物负载于具有乏氧响应的纳米组装体中,进入肿瘤乏氧环境,响应释放。这两种方法均表现出良好的肿瘤靶向治疗效果,但仍然存在一定的局限性:共价前药的合成纯化过程复杂,且缺乏广谱通用性;而各类纳米载药体系通常存在分子结构与分子量不明确和批次重现性差等问题。
基于此,南开大学化学学院郭东升教授、史林启教授、刘阳研究员、中国医学科学院黄帆副研究员合作发展建立了新型的乏氧响应的主客体药物递送体系。以第三代超分子主体—杯芳烃为核心骨架,设计合成了一种乏氧响应的分子容器—羧基偶氮杯[4]芳烃(CAC4A)作为新型载体材料,通过主客体包结构建了超分子前药,借助偶氮基团的乏氧响应特性,实现了抗肿瘤药物的靶向递送(图1)。该主客体药物递送体系具有多方面的优势。相比于共价前药策略,基于主客体化学的超分子前药策略具有易于构筑、原形释放和普适通用等优势。相比于纳米载药体系,主客体载药体系结构和分子量明确、批次重现性好。此外,得益于确切的主客体络合稳定常数和识别选择性,可以实现对给定药物的定量负载。
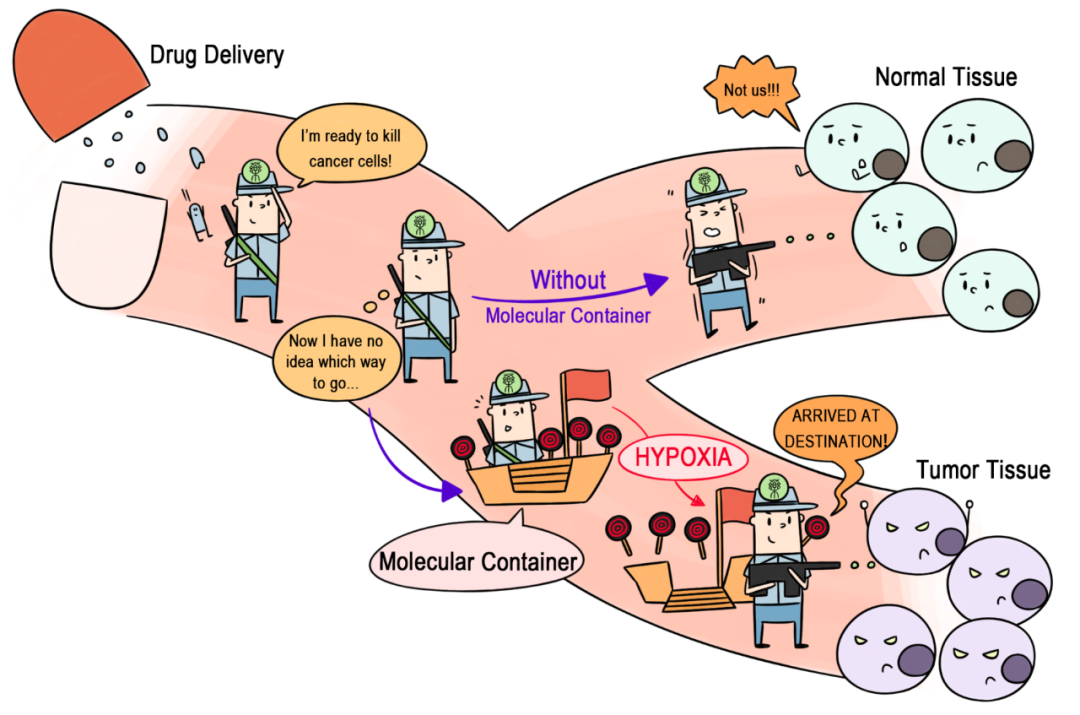
图1 CAC4A与抗肿瘤药物通过主客体络合形成超分子前药及相应的乏氧响应传递机制的示意图
CAC4A作为通用的载药平台
作为一种新型载体材料,CAC4A易于制备,杯[4]芳烃与4-氨基苯甲酸在温和条件下通过重氮偶联反应仅需2 h即可获得,产率高达90%。与母体杯芳烃相比,CAC4A具有深穴空腔,对疏水药物具有较高的亲和力;上缘羧基官能团一方面赋予了杯芳烃水溶性,另一方面提供了额外键合位点,增强对客体分子(特别是正电性客体)的键合能力。作者尝试了17种临床使用的化疗药物,CAC4A对其中12种给出强的主客体识别能力(键合常数大于105 м-1,表1),验证了CAC4A作为载药平台的广谱通用性。CAC4A的包结还有效改善了药物的溶解度和稳定性(图2a和b)。
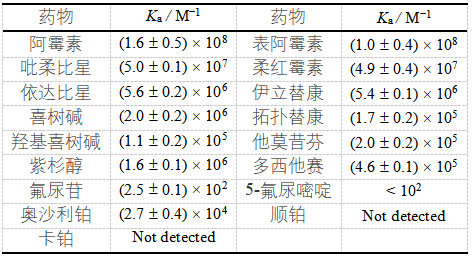
表1 CAC4A与17种抗肿瘤药物键合常数
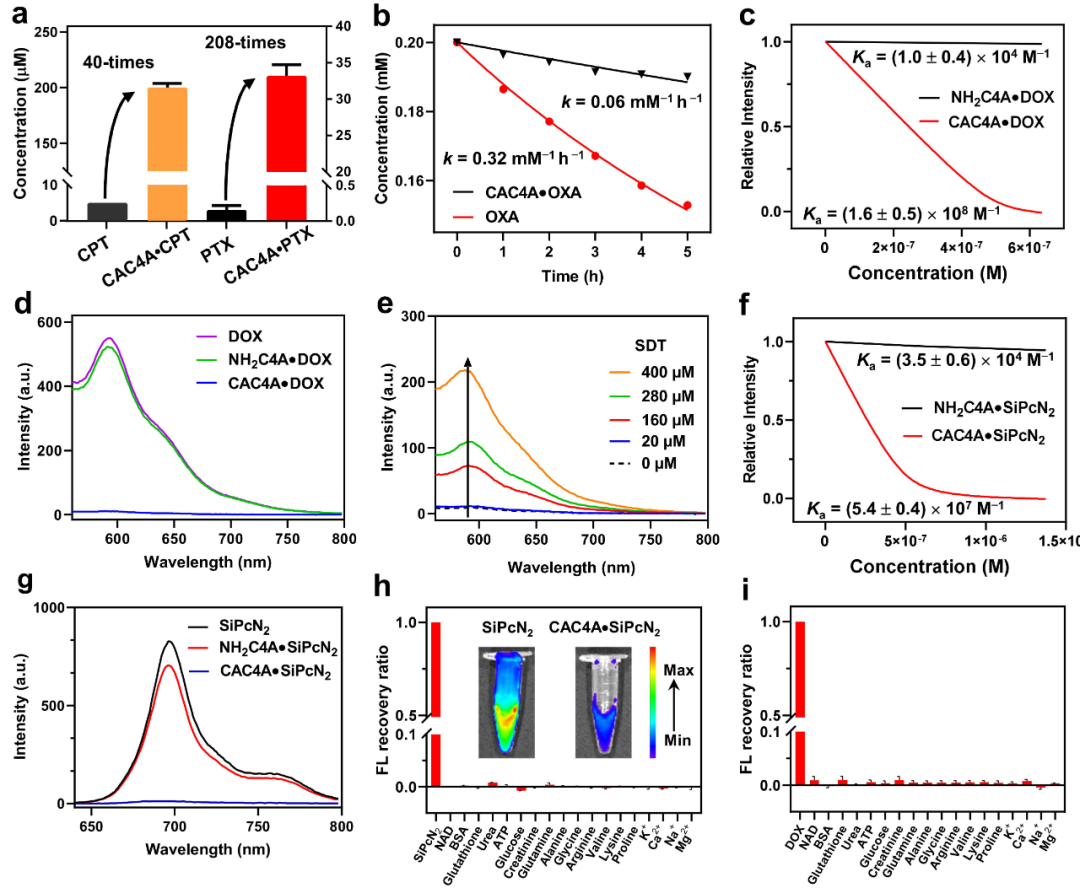
图2 CAC4A增溶药物,提升药物稳定性以及乏氧响应、抗血液干扰物研究
CAC4A的乏氧响应及可控释放
为了证明CAC4A具有乏氧响应的控制释放药物能力,作者对比研究了CAC4A和还原产物氨基杯芳烃(NH2C4A)对DOX和SiPcN2的键合能力(图2c,d,f和g),其键合常数差异显著,大于三个数量级,为乏氧响应的药物递送提供了理论依据。进而,在CAC4A•DOX络合物中加入0 ~ 400×10-6 M不同浓度的连二亚硫酸钠(SDT,一种偶氮还原酶的模拟还原剂)后,DOX的荧光逐渐恢复(图2e),证明CAC4A被还原后,释放了药物分子。得益于CAC4A对诊疗试剂的选择性强键合,包合物能够抗血液干扰物的竞争干扰(图2h和i),避免了在循环过程中提前脱靶泄露。在活体成像中,以SiPcN2作为荧光探针,CAC4A•SiPcN2组在小鼠肿瘤中的荧光信号随时间的推移而逐渐增强,并在注射72小时后达到最大水平(图3a),说明CAC4A在肿瘤乏氧条件下释放了SiPcN2,荧光被重新激活。相比之下,SiPcN2组的荧光强度没有随时间发生改变(图3b)。进一步的定量分析(图3c和d)显示,CAC4A•SiPcN2组小鼠肿瘤的平均荧光强度比SiPcN2组高2倍,表明了CAC4A•SiPcN2在肿瘤诊断和成像中的应用潜力。
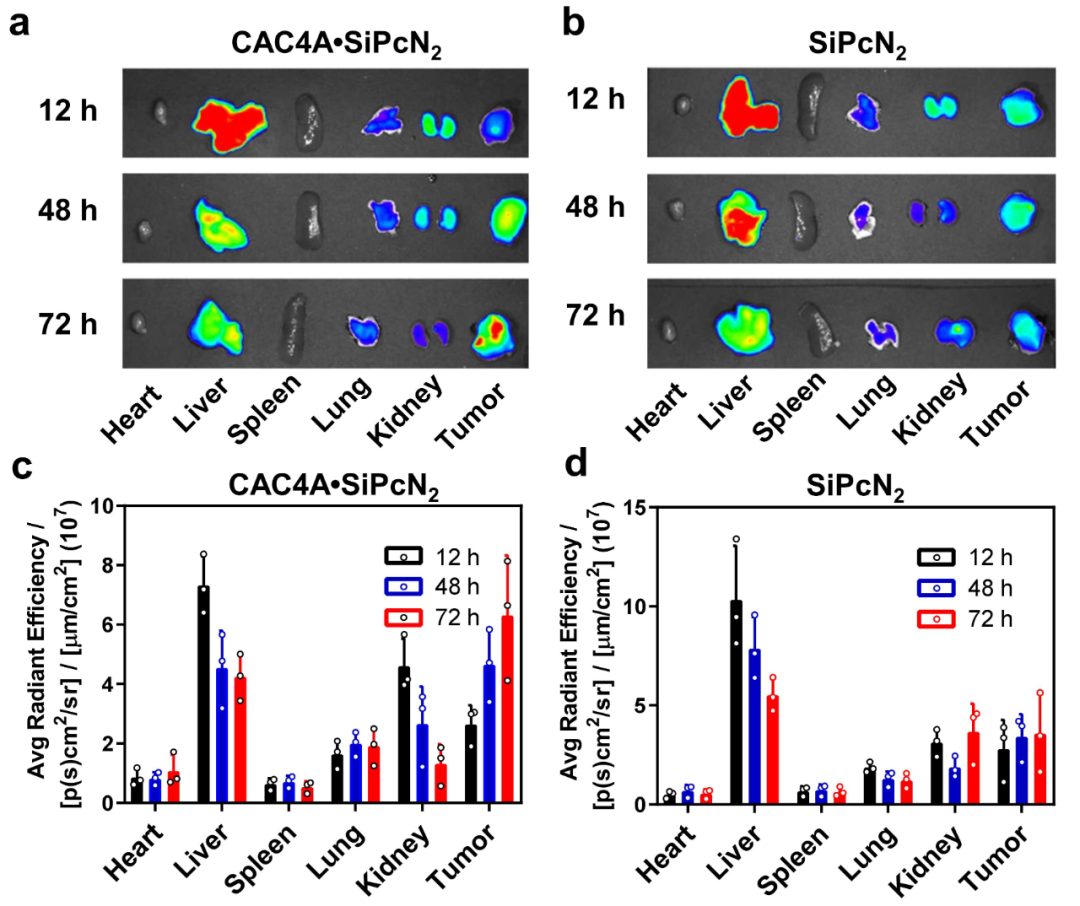
图3 CAC4A•SiPcN2离体成像及定量分析
CAC4A•DOX体内抗肿瘤效果
为了进一步验证CAC4A作为一种超分子载体在肿瘤靶向治疗中的应用,作者以超分子前药CAC4A•DOX为例,采用4T1小鼠乳腺癌细胞皮下荷瘤BALB/c小鼠模型,通过尾静脉给药的方式研究了抗肿瘤效果。通过CAC4A•DOX组与PBS、CAC4A、DOX三个对照组比较,发现在降低给药剂量的情况下CAC4A•DOX组仍表现出显著的抗肿瘤作用(图4),且降低了DOX的毒副作用。研究结果表明,该乏氧响应的超分子前药策略能够降低给药剂量,优化药物的体内分布和肿瘤富集,进而提升抗肿瘤药物的靶向治疗效果并降低其毒副作用。论文以A General Hypoxia-Responsive Molecular Container for Tumor-Targeted Therapy为题在线发表在Advanced Materials(DOI: 10.1002/adma.201908435)上。
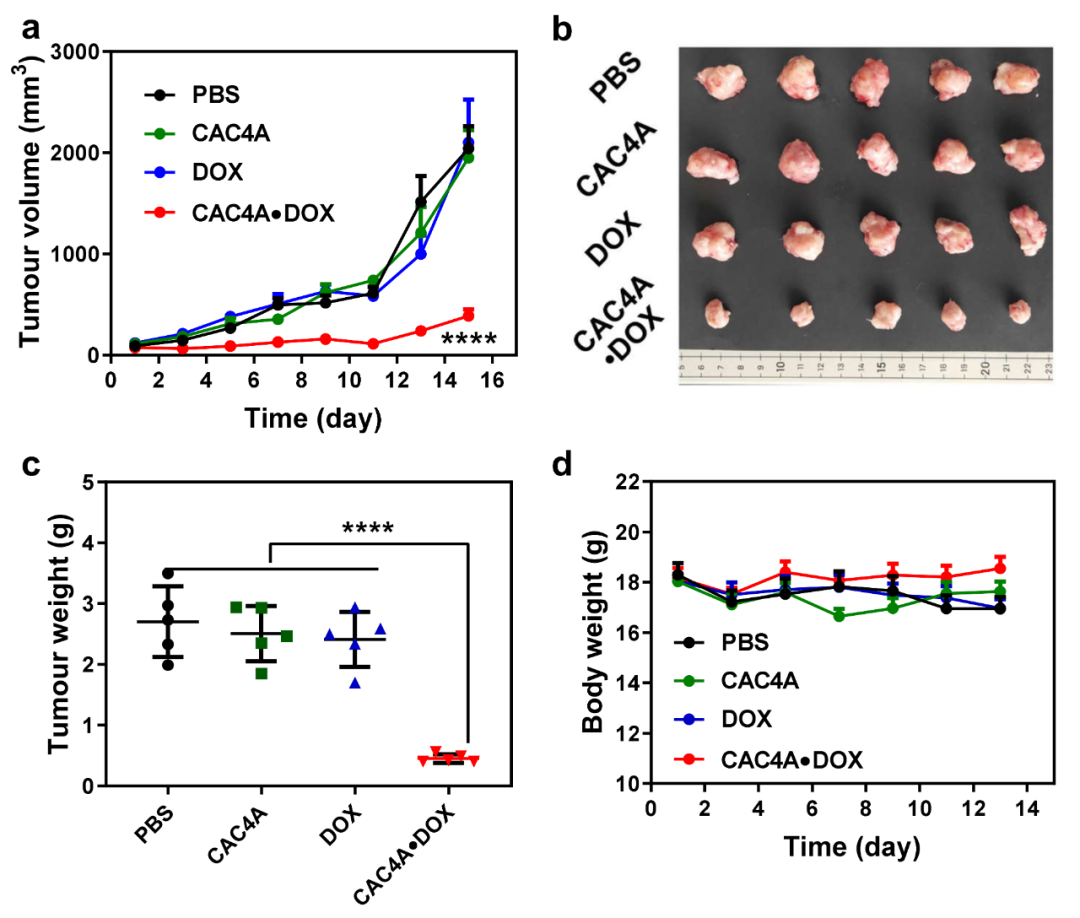
图4 CAC4A•DOX体内抗肿瘤效果




