来源:催化计

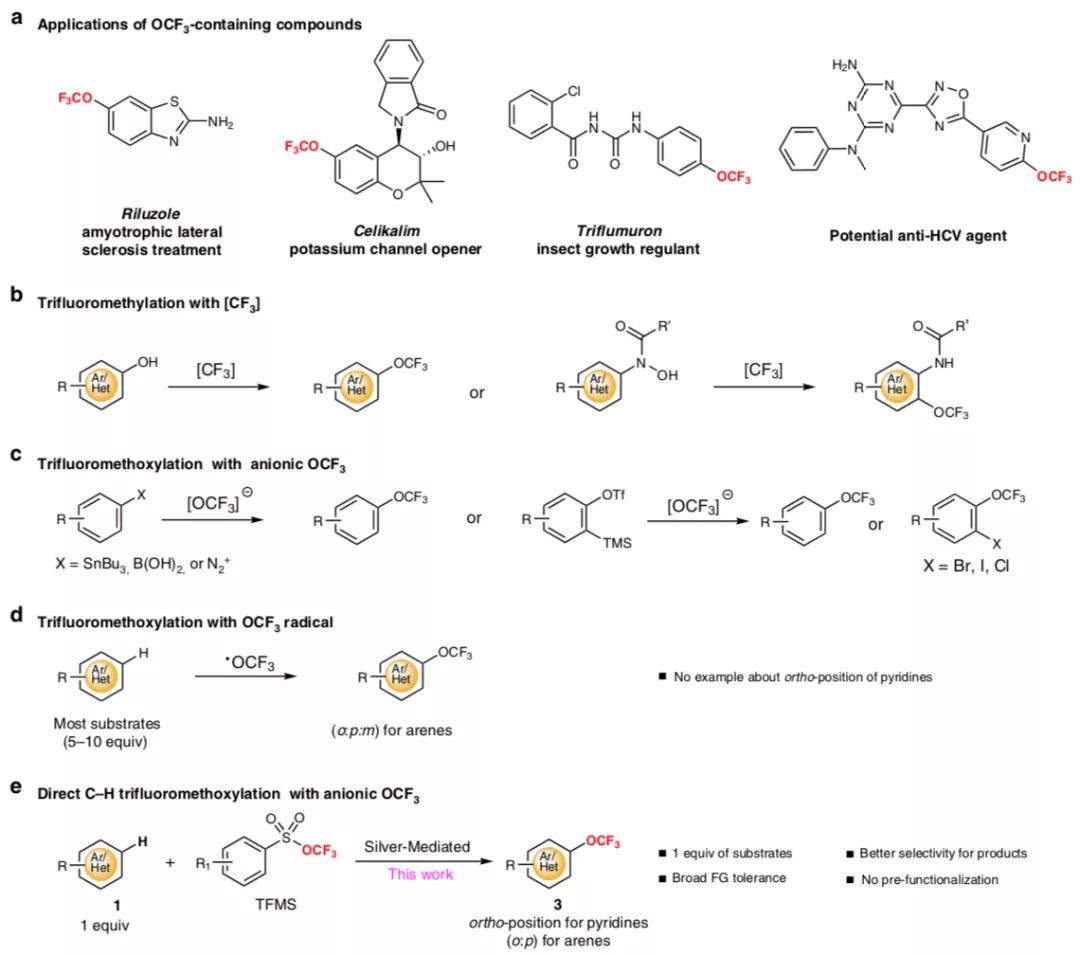
三氟甲氧基化(trifluoromethoxylation)的产物在医药,农药和材料科学等领域有重要作用,但是芳烃/杂环芳烃的直接三氟甲氧基化方法比较罕见,特别是对吡啶分子的三氟甲氧基化反应。
有鉴于此,南开大学汤平平等报道了一种对C-H键的三氟甲氧基化普遍适用的方法,通过在温和条件中和银盐反应,并且对广泛的官能团具有兼容性,该方法对多种底物有反应活性。此外,在吡啶的反应中展现了邻位C-H键三氟甲氧基化过程,该方法适配于克级合成中,同时可以对多种市售小分子药物分子,药物官能团,天然产物的后期三氟甲氧基化反应。
本文要点
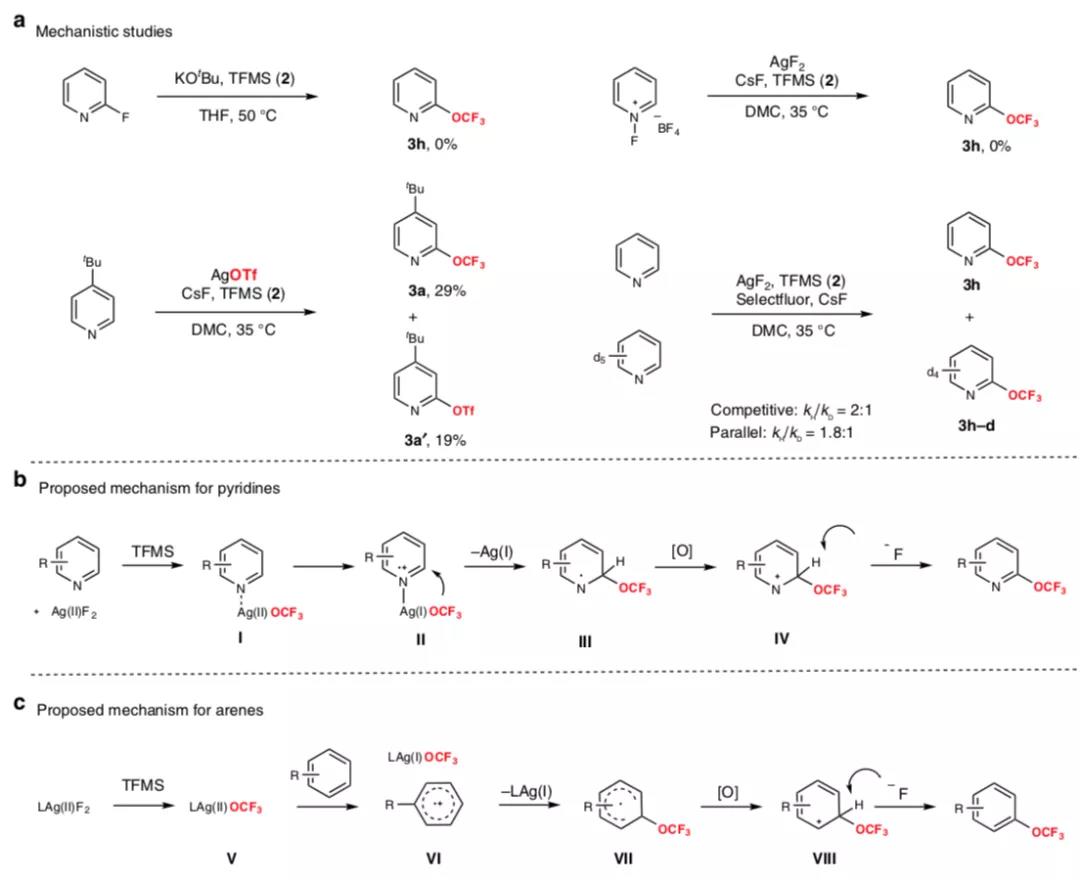
要点1. 反应优化。将对叔丁基吡啶作为反应底物,3倍量的对氟三氟甲氧基苯磺酸(TFMS)作为三氟甲氧基试剂,2倍量的氧化剂,1倍量的银盐,3倍量的氟化物,在35 ℃中DMC溶剂反应。对银盐进行筛选(Ag2O, AgF, AgO, AgF2, Ag2CO3),结果显示AgF2有最好的效果;对氧化剂进行筛选(Selectfluor, K2S2O8, NFSI, PhI(OAc)2),结果显示Selectfluor有最好的效果;对加入的氟化物进行筛选(CsF, KF, NaF, Et3N·HF),结果显示CsF有最好的效果。优化后的反应实现了62 %的产率。该反应在N2保护气氛中进行反应。对依托洛昔布、托品酰胺、罗苏伐他汀、vismodegib、舒巴坦、石胆酸、丹参酮IIA、芹菜素、非诺贝特等复杂分子实现了三氟甲氧基化反应。
要点2. 反应机理。在吡啶官能团化反应中的机理:Ag(II)F2和吡啶、TFMS进行配合反应,Ag(II)配位到吡啶分子的N上,并和TFMS脱除的OCF3配合形成Ag(I)PyOCF3,随后消除Ag(I)的同时Ag配位的OCF3转移到吡啶的α-C上,打开α-位的双键,随后在氟化物进攻作用中重新形成吡啶环,得到α-位OCF3取代的吡啶。在芳环底物官能团化反应中的机理:LAg(II)F2在TFMS活化作用形成LAg(II)OCF3,随后Ag(II)氧化芳环,形成对应的芳环正离子自由基,还原后的Ag(I)将配位的OCF3脱除,并加成到芳环正离子自由基上,最后在氟化物亲核进攻作用中,重新形成芳环,生成OCF3取代的芳环产物。
Zhijie Deng, Mingxin Zhao, Feng Wang & Pingping Tang*. Selective C-H trifluoromethoxylation of (hetero)arenes as limiting reagent,Nature Commun 2020, 11, 2569
DOI:10.1038/s41467-020-16451-x
https://www.nature.com/articles/s41467-020-16451-x




