来源:高分子科技
癌症疫苗通过激活人体自身的免疫系统来消除肿瘤,已经成为最有前途的癌症治疗策略之一。然而,目前大多数已获许可的疫苗只能诱导CD4+ T细胞介导的体液免疫,而不能诱导CD8+ T细胞调节的细胞免疫,对癌症患者的治疗效果有限,临床效益不理想。热休克蛋白(HSPs)是生物体内最丰富、最普遍的分子伴侣之一,它不仅是复杂蛋白稳态的有效调节因子,而且是免疫系统强有力的激活因子。HSPs可以通过其独特的蛋白结合域捕获肿瘤抗原,形成稳定的HSP-抗原复合物。随后,HSP通过与抗原提呈细胞(APCs)表面受体的相互作用被顺利内化,并通过MHC I和MHC II途径呈递抗原,从而激活细胞毒性T细胞(CD8+)和T辅助细胞(CD4+),发挥其免疫功能。
近日,南开大学化学学院史林启教授团队联合中国医学科学院放射医学研究所刘鉴峰研究员团队在国际知名学术期刊Nano Letters(DOI: 10.1021/acs.nanolett.0c01230)上发表文章。该研究利用表面修饰甘露糖的混合壳层胶束模拟热休克蛋白的结构和功能,构建了一种新型的纳米分子伴侣(nChap)作为纳米疫苗用于激活抗肿瘤免疫反应。nChap的表面由塌缩的pH响应性疏水微区与伸展的亲水聚合物链段组成,从而形成类似热休克蛋白的疏水结合域和空腔,可以捕获抗原并通过受体介导作用将其靶向递送至树突状细胞(DCs)。随后,nChap借助疏水微区在酸性条件下的质子海绵效应破坏溶酶体,从而促进抗原逃逸并增强其在细胞质中的交叉递呈,进而同时诱导基于CD4+和CD8+ T细胞的免疫反应,从而实现对肿瘤细胞的高效杀伤(图1)。
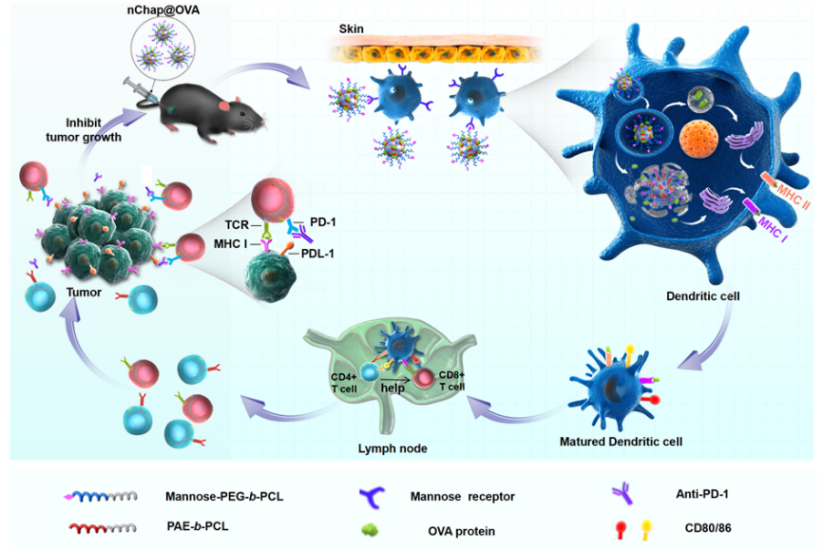
图1. 基于纳米分子伴侣的癌症疫苗用于癌症免疫疗法的原理图。
研究人员首先以鸡卵清蛋白(OVA)为抗原模型,研究nChap对OVA的捕获能力。动态光散射(DLS)和荧光共振能量转移实验(FRET)结果均表明nChap通过疏水微区可成功捕获OVA形成纳米分子伴侣-OVA复合物(nChap@OVA)(图2b-d)。同时,nChap@OVA在不同pH条件下的粒径变化以及在体外OVA的累计释放结果均显示nChap具有可逆捕捉/释放OVA的能力(图2e-f)。
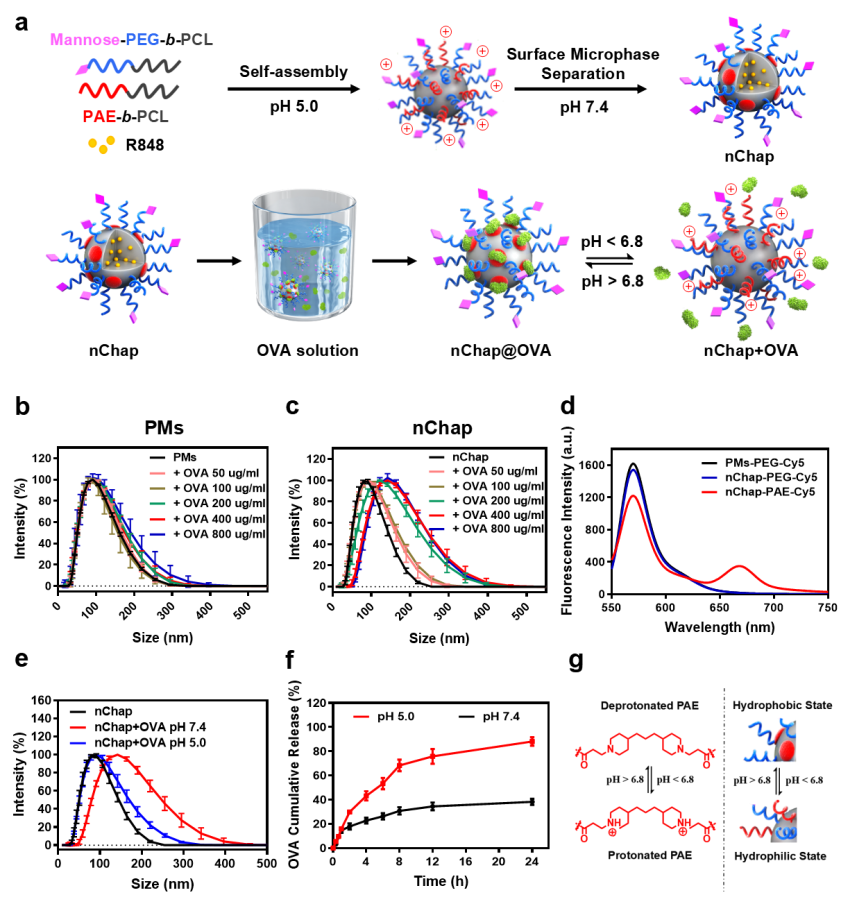
图2. (a) nChap@OVA纳米疫苗制备示意图, (b, c) PMs和nChap在不同浓度的OVA下的尺寸分布变化, (d) 荧光共振转移图, (e) nChap捕获/释放OVA后粒径的分布, (f) nChap@OVA体外累积释放曲线, (g) PAE链的质子化/去质子化以实现其亲水/疏水转化的示意图
接下来,研究人员考察了纳米分子伴侣疫苗的细胞内化,促进抗原溶酶体逃逸以及诱导骨髓源树突状细胞(BMDCs)成熟的能力。激光共聚焦和流式细胞术的结果表示,甘露糖修饰的纳米疫苗可以促进DC细胞对其的摄取(图3a-c)。进一步共定位实验发现,当进入溶酶体酸性环境后,纳米分子伴侣的疏水微区链段会通过质子海绵效应促进溶酶体的破裂,从而实现抗原的胞质递送(图3d-f)。同时,纳米分子伴侣疫苗成功激活了BMDCs,上调了BMDCs表面多种成熟信号(图3g-j)。
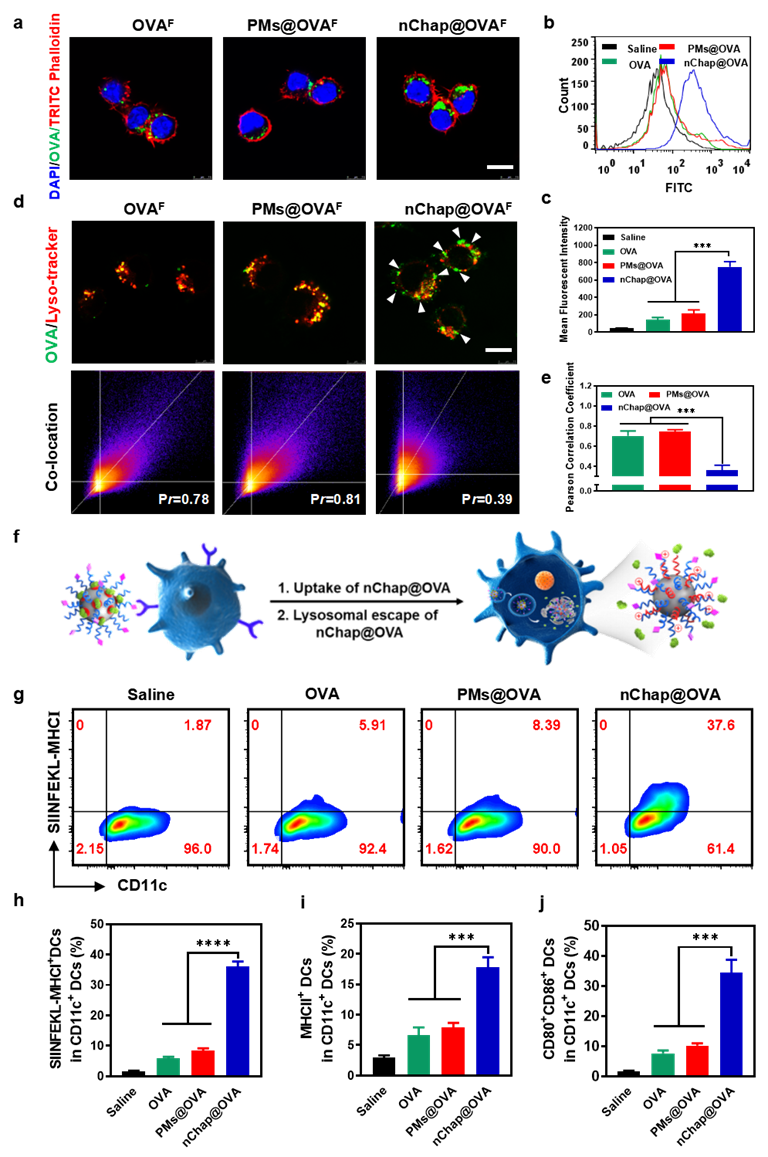
图3. (a,b,c)细胞摄取的激光共聚焦图像和流式细胞术检测及统计数据, (d)nChap辅助OVA溶酶体逃逸, (e)皮尔逊相关系数分析, (f)甘露糖介导nChap@OVA被DC细胞内化以及PAE的质子海绵效应促进抗原溶酶体逃逸示意图, (g-j)BMDCs表面成熟信号的表达
研究人员还考察了纳米分子伴侣作为预防性疫苗在小鼠体内的抑瘤效果。实验结果表明纳米伴侣疫苗可有效抑制黑色素瘤的生长并延长了小鼠的生存周期(图4b-c)。此外,经nChap@OVA免疫后的小鼠脾脏中CD8+T细胞的百分比明显增加,并且当脾细胞被抗原重新刺激之后,OVA特异性的CD8+ T细胞迅速增殖(图4e-i)。值得注意的是,这些CD8+ T细胞可选择性的直接杀伤B16F10-OVA黑色素瘤(图4j)。此外, nChap@OVA组小鼠血清中肿瘤坏死因子-α (TNF-α)和干扰素-γ (IFN-γ)都明显上调(图4k-l)。以上结果证明nChap@OVA纳米疫苗能诱导强烈的免疫反应,并且特异性地清除肿瘤。

图4. (a)免疫预防组实验方案, (b)荷瘤小鼠的平均肿瘤生长曲线, (c)各组小鼠的生存曲线, (d)各组小鼠体重变化, (e, f)免疫后小鼠脾脏中CD8+ T细胞和CD4+ T细胞含量, (g, h)脾脏细胞中T细胞的增殖情况, (i)脾脏细胞中CD3+CD8+CD107+ T细胞的含量, (j)CD8+ T细胞对肿瘤的特异性杀伤能力, (k, l)免疫小鼠血清中TNF-α和IFN-γ的含量
除此之外,研究人员进一步评估了基于nChap的纳米疫苗与anti-PD-1检查点阻断的联合治疗效果。结果显示,单纯使用anti-PD-1或nChap@OVA 纳米疫苗仅能稍微延缓肿瘤的生长,在28-32天内全部小鼠死亡。而联合治疗能有效抑制肿瘤生长,延长小鼠生存时间至50天以上(图5 b-c)。究其原因是,纳米分子伴侣疫苗可以同时激活CD4+ T细胞和CD8+ T细胞,并促进它们在肿瘤中的积累。而anti-PD-1抗体能有效减少肿瘤细胞对T细胞的耗竭,进一步增强T细胞向肿瘤的浸润,从而在联合免疫治疗中实现协同抗肿瘤反应(图5 e-i)。
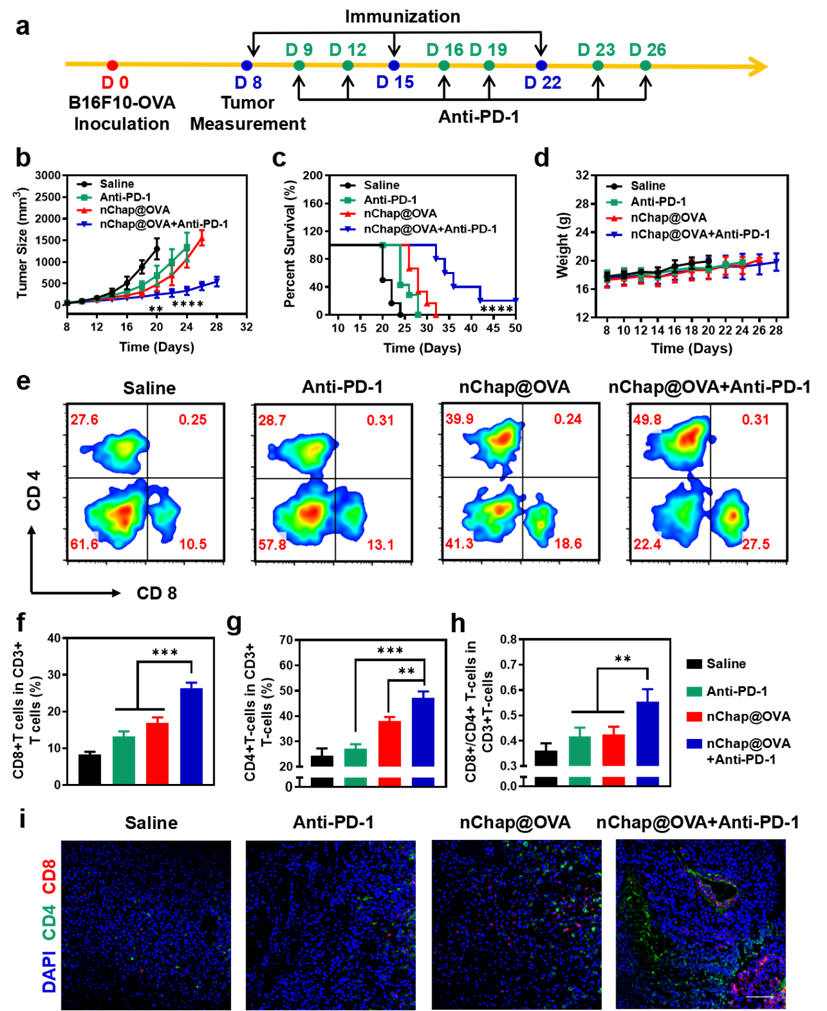
图5. (a)针对已建立B16F10-OVA肿瘤的小鼠的免疫治疗方案, (b)各组小鼠肿瘤生长曲线, (c)各组小鼠的生存曲线, (d)各组小鼠体重变化曲线, (e-h)各组小鼠肿瘤中CD8+ T细胞和CD4+ T细胞的数量以及两者的比值, (i)肿瘤切片免疫荧光染色
以上体外/体内实验结果均表明,这种基于纳米分子伴侣的疫苗可以有效地模仿HSPs的结构和功能,实现疏水微区结构辅助的抗原捕获、表面受体介导的DCs内化以及对体液免疫和细胞免疫的双重激活,有望为开发高效的仿生纳米疫苗提供新的策略与思路。
论文的第一作者为南开大学化学学院李雪博士。南开大学化学学院史林启教授,刘阳研究员和中国医学科学院放射医学研究所刘鉴峰研究员、黄帆副研究员为论文的共同通讯作者。
论文链接:
https://pubs.acs.org/doi/10.1021/acs.nanolett.0c01230




