手性四氢吡啶广泛存在于天然产物与生物活性分子中,不对称氮杂Diels-Alder反应则是构筑该类化合物最高效和原子经济性的方法之一。然而,酮亚胺与非活化二烯的不对称氮杂Diels-Alder反应至今还未有报道,仍面临着挑战(图1)。
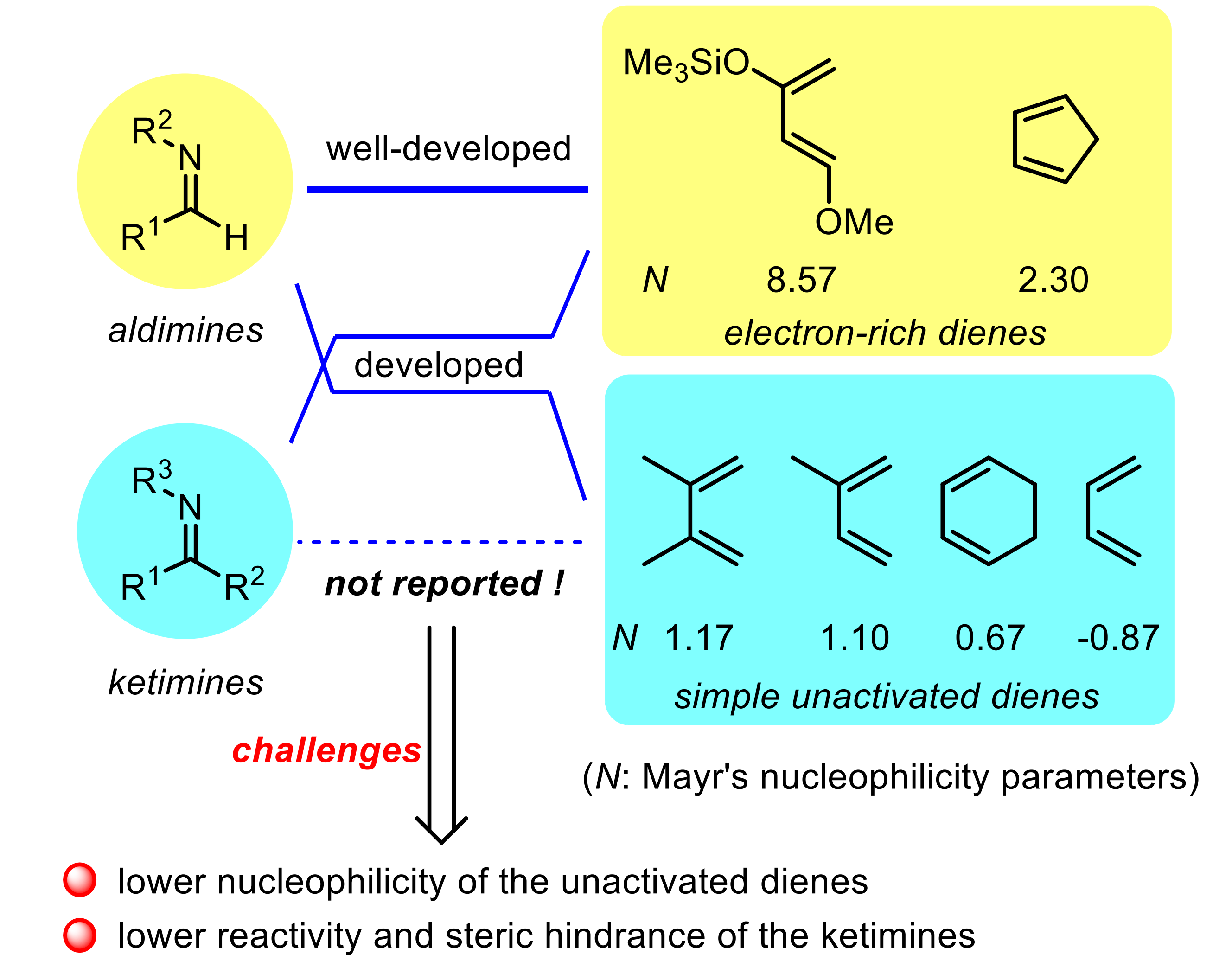
图1
近日,李鑫课题组借助于DFT计算,成功实现了B(C6F5)3/手性磷酸(CPA)催化的酮亚胺与非活化二烯的不对称氮杂Diels-Alder反应(图2),以高收率(up to 99%)与高立体选择性(up to >20:1 dr, 98:2 er)得到了含有季碳手性中心的四氢吡啶化合物。
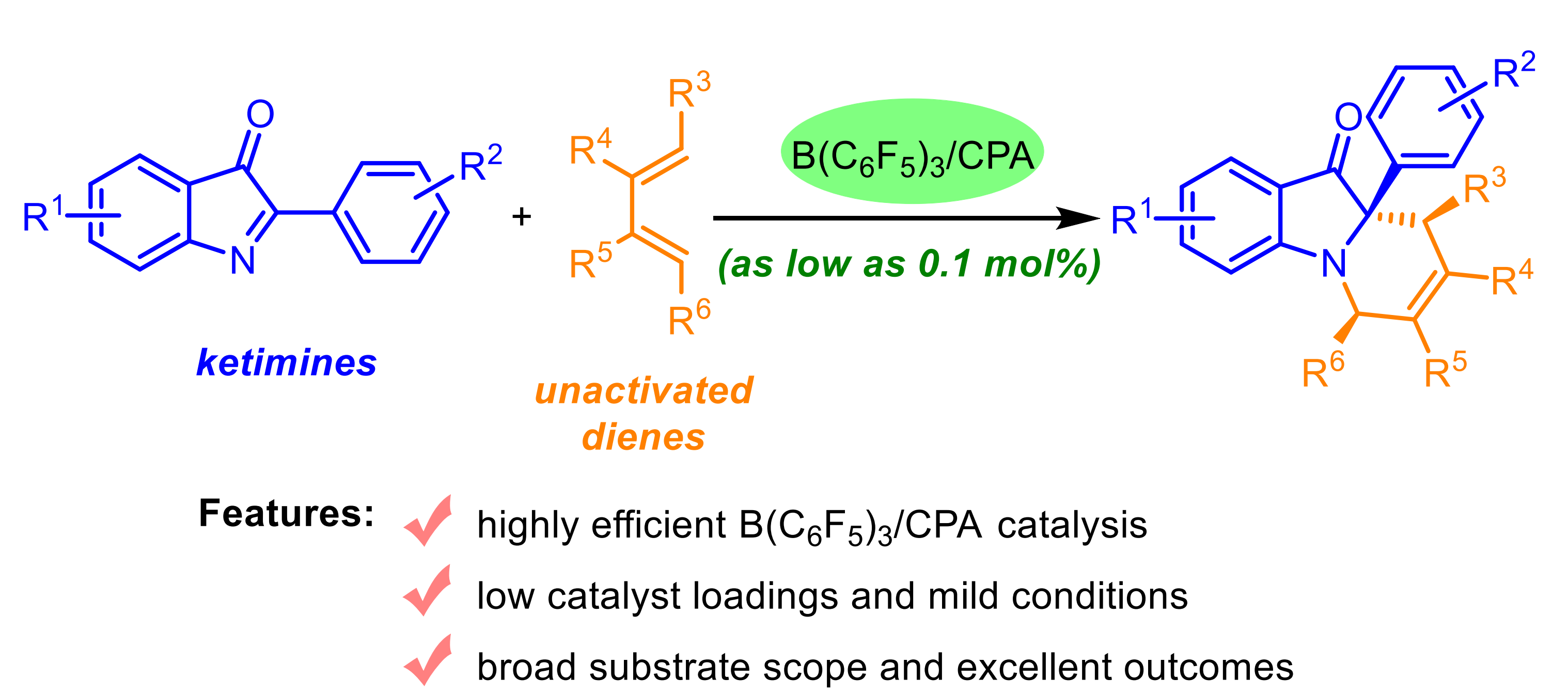
图2
首先,作者对一系列常见的酮亚胺及酮亚胺—催化剂复合物进行了亲电指数(ω)的计算(图3),发现2-苯基-3H-吲哚-3-酮(F)在B(C6F5)3/磷酸(PA)的活化下亲电性增强最为明显,是最合适的候选底物。
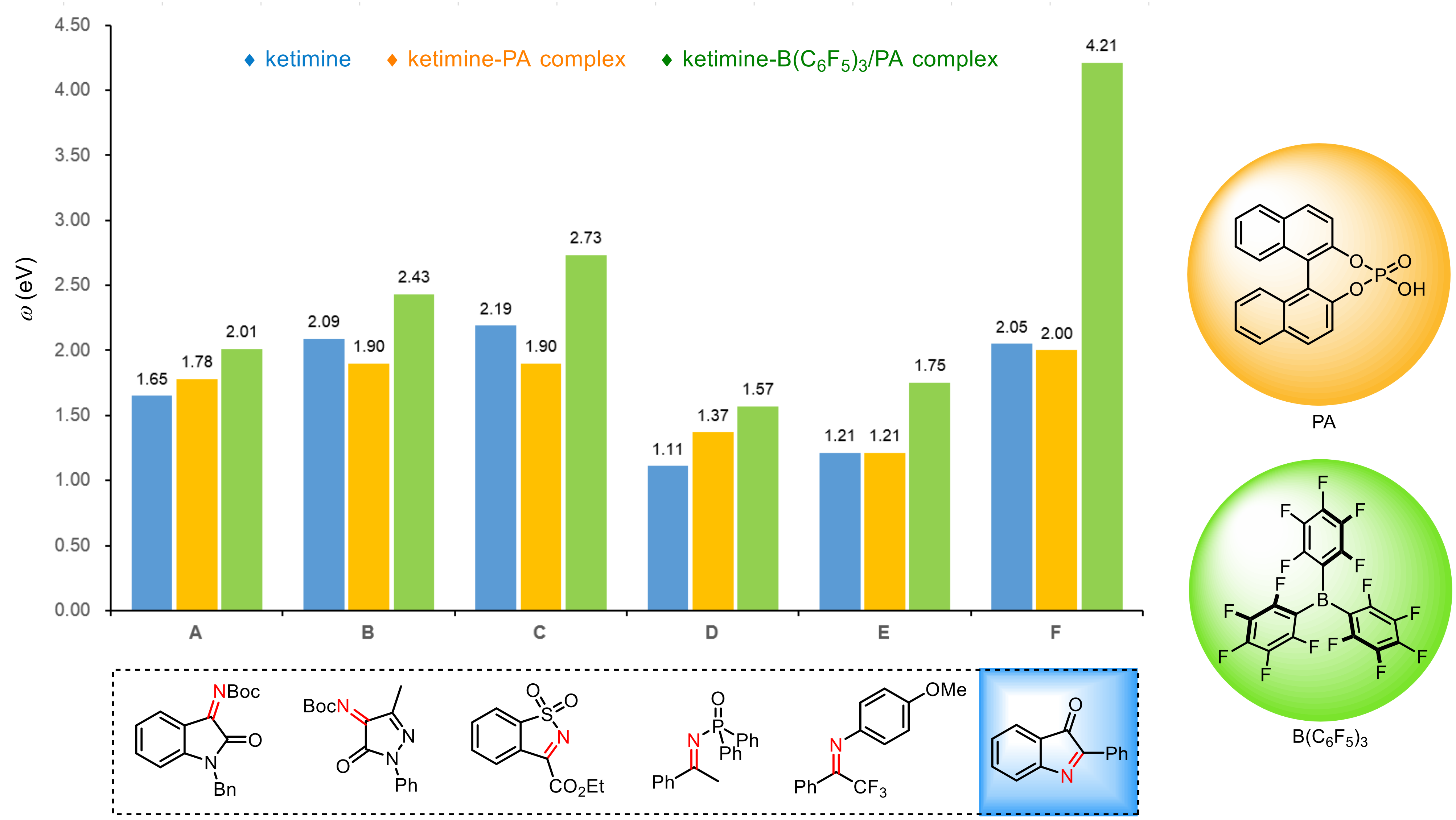
图3
在最优反应条件下,作者对酮亚胺与非活化二烯底物的适用范围进行了考察(图4)。结果表明,对于酮亚胺,不同位置、不同电性的取代基均具有很好的兼容性;对于各种非活化二烯,反应结果同样令人满意,甚至较为惰性的1,3-丁二烯也可适用于该反应,以高产率和高对映选择性得到目标产物。值得一提的是,在模板反应的克级实验中,催化剂用量最低可降至0.1 mol%,产物的对映选择性仍然保持。
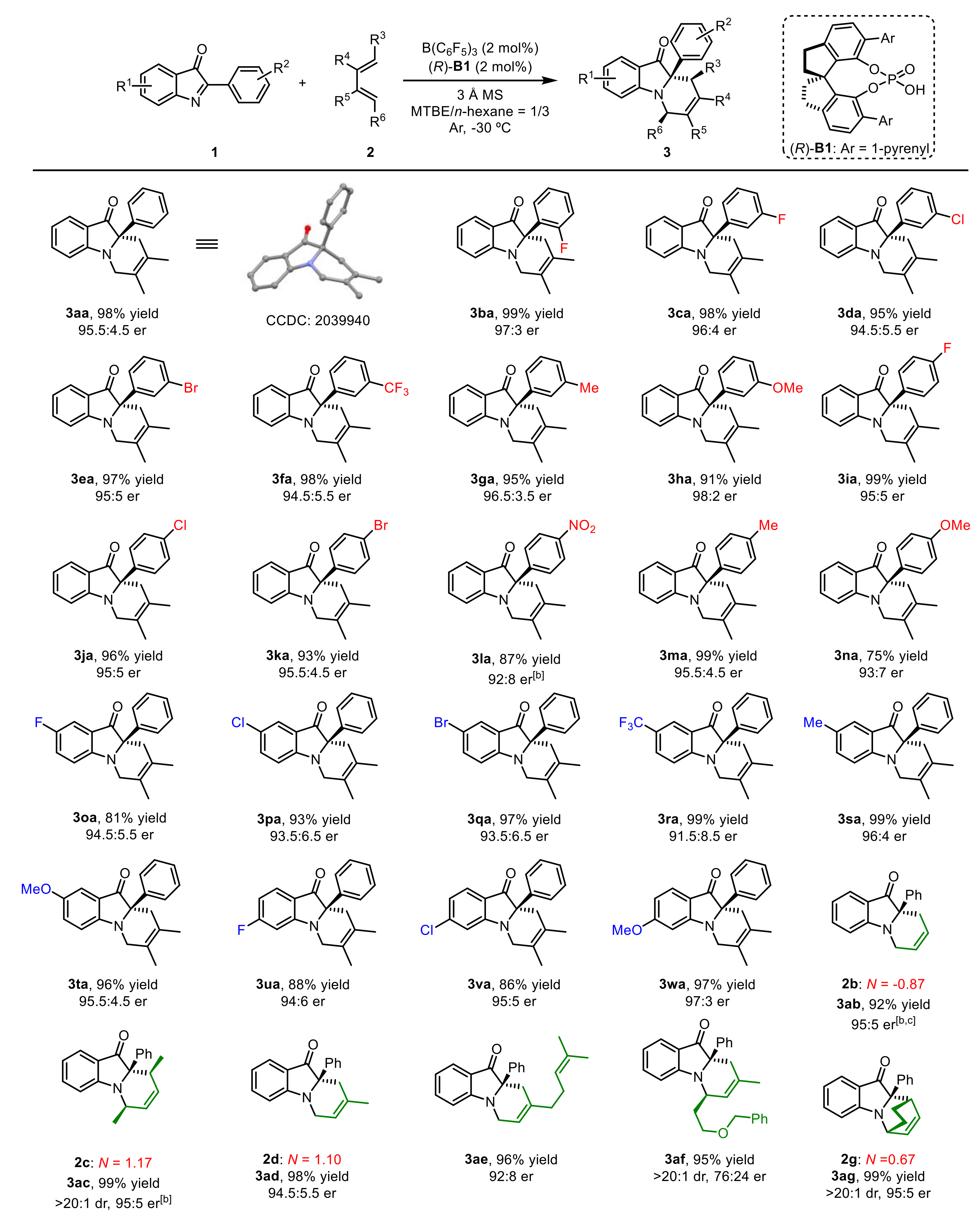
图4
最后,作者对反应机理进行了详细研究,DFT计算表明次级轨道相互作用(SOI)与非共价相互作用(NCI)是产生高立体选择性的原因(图5)。值得注意的是,F原子产生的C-H…F弱相互作用也有助于立体选择性的控制。
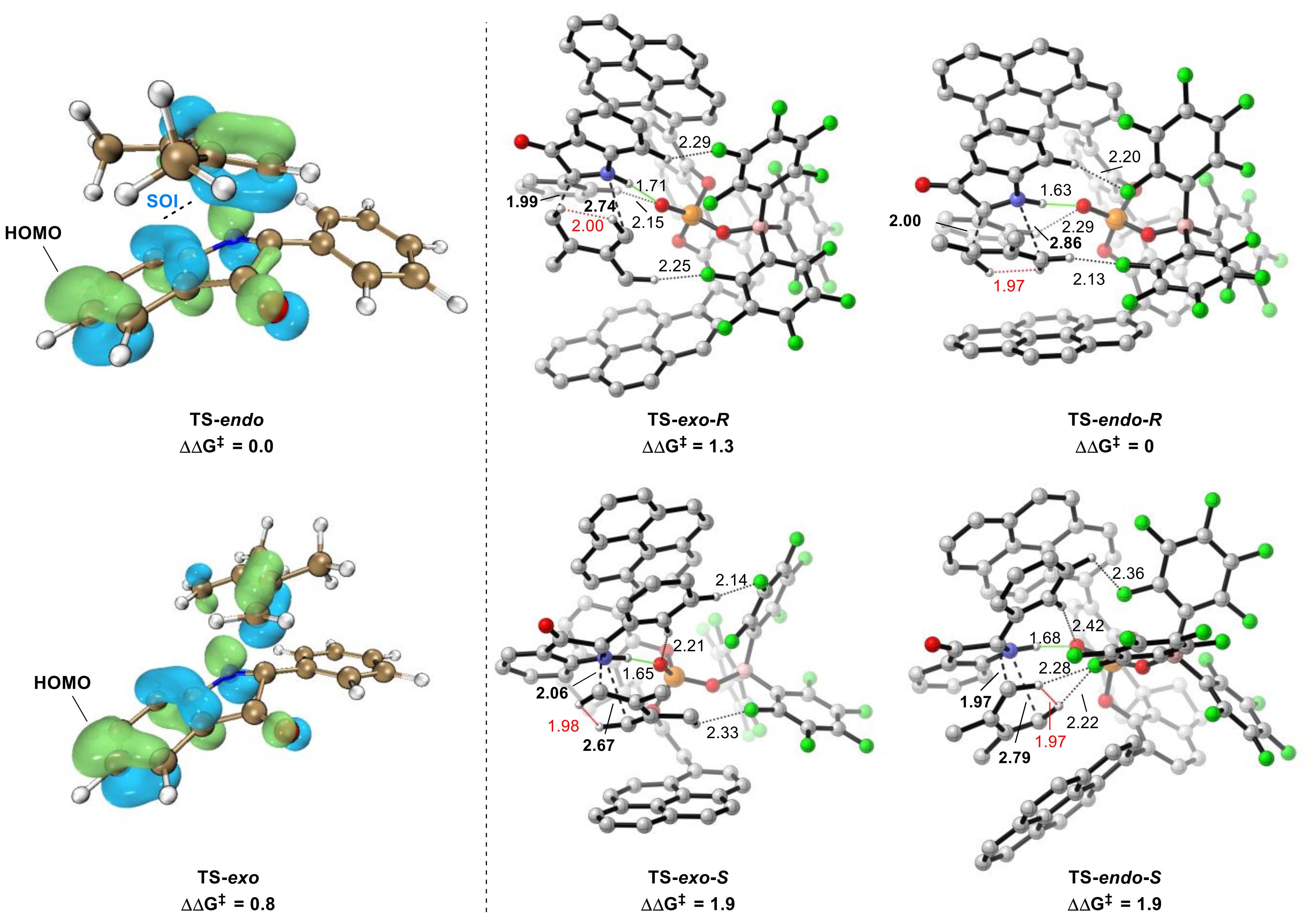
图5
综上所述,李鑫课题组发展了B(C6F5)3/CPA催化的酮亚胺与非活化二烯的不对称氮杂Diels-Alder反应,以高产率与高立体选择性得到了含有季碳手性中心的四氢吡啶化合物。可以预见,这种简单的B(C6F5)3/CPA协同催化体系有望实现更多惰性底物参与的不对称转化。
南开大学博士研究生赵群为论文第一作者。该工作得到了国家自然科学基金与元素有机国家重点实验室的资助。
论文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202104788




