恶性肿瘤是人类健康的重大威胁,而研究人员发现恶性肿瘤往往具有乏氧的特性。随着乏氧程度的增加,恶性肿瘤的传统化疗与放疗治疗效果都将大打折扣。硝基还原酶(NTR)是实体瘤乏氧区域过度表达常见还原酶,开发硝基还原酶响应的纳米结构在实体瘤的有效检测与治疗方面具有重大意义。针对这一重大需求,南开大学化学学院余志林课题组报道了一种具有NTR-响应的非经典氨基酸,可在肿瘤乏氧区域基于硝基还原有效调控多肽组装,同时开启纳米结构荧光特性,实现实体瘤乏氧区域的荧光成像检测。该氨基酸在硝基还原作用下疏水的硝基转化成亲水氨基,促进多肽从纳米纤维结构向纳米颗粒转变,同时抑制硝基咪唑对荧光基团的淬灭机制。基于多肽纳米结构的形貌转变以及荧光恢复,所制备的超分子荧光探针可对实体瘤乏氧区域高效富集-渗透成像。近期,该成果以“Noncanonical Amino Acids for Hypoxia-Responsive Peptide Self-Assembly and Fluorescence”为题,发表于J. Am. Chem. Soc.上(DOI: 10.1021/jacs.1c06435)。
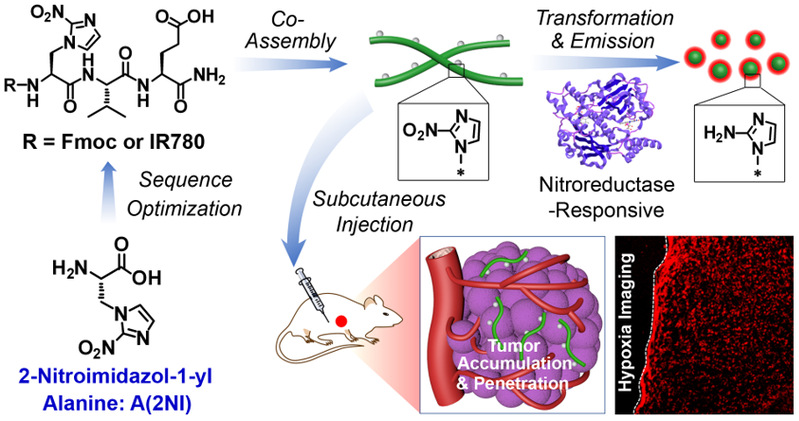
基于2-硝基咪唑丙氨酸(A(2NI))的多肽可控组装及肿瘤荧光成像。图片来源 J. Am. Chem. Soc.
多肽纳米结构特征与氨基酸序列具有极其重要的关系。基于氨基酸的刺激响应反应改变氨基酸序列、从而调控多肽组装是实现多肽可控组装的有效方法。在前期工作的基础上(Nano Today 2021, 38, 101198;Chemical Science 2020, 11, 1383;Nano Letters 2019, 19, 7965),余志林课题组基于天然组氨酸及硝基咪唑基团的还原响应特征,利用光延反应合成了新型氨基酸2-硝基咪唑丙氨酸。通过优化多肽序列,实现了硝基还原酶响应性。结果表明多肽的N-端方向基团以及C-端负电荷残基是硝基还原响应性的必要结构特征。并通过进一步调控多肽疏水性,达到基于硝基还原的多肽纳米结构形貌转变目标。
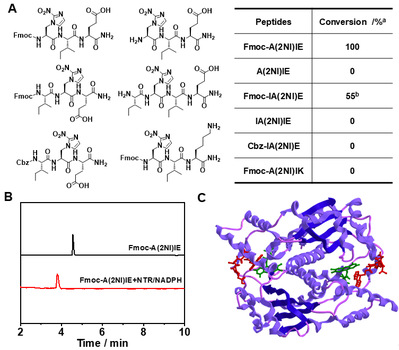
图1. 含A(2NI)多肽分子的硝基还原酶响应性。
基于2-硝基咪唑对荧光基团的荧光猝灭机制,对含该非天然氨基酸的多肽分子进行荧光基团修饰,构筑了一种乏氧响应的超分子荧光探针。基于硝基还原酶调控的形貌转变以及荧光恢复,该探针在活体层面显示良好的肿瘤富集和高效渗透能力,从而对乏氧区域肿瘤细胞有效成像。该新型氨基酸有望广泛用于调控乏氧区域多肽和蛋白质行为方面,从而拓展生物医用功能材料的制备与开发。
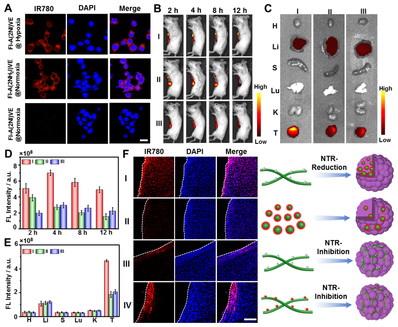
图2 超分子纳米探针对乏氧条件下的细胞及活体内实体瘤成像结果。图片来源 J. Am. Chem. Soc.
论文得到了国家自然科学基金委及中央高校基础科研经费支持。论文第一作者是南开大学博士研究生胡彬彬,通讯作者为南开大学化学学院余志林研究员。
论文连接:https://pubs.acs.org/doi/10.1021/jacs.1c06435




