来源:CBG咨询中心
导语:
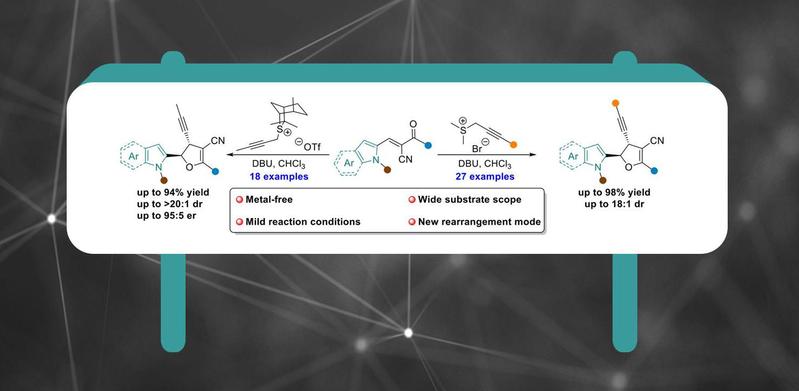
硫叶立德最初作为亚甲基转移试剂,被广泛应用于合成环氧乙烷、吖啶及环丙烷类化合物。随着有机合成化学的不断发展,多种硫叶立德及其前体锍盐被发现,并应用于更加复杂的单环和多元并环类化合物的合成。近日,南开大学黄有教授课题组通过对反应底物的巧妙设计,使用炔丙基锍盐作为C1合成子,先构筑DA(donor-acceptor)环丙烷中间体,再通过去芳构化策略,实现了串联Corey−Chaykovsky环丙化/Cloke−Wilson重排反应,对映选择性构筑了一系列2,3-二氢呋喃类化合物(图1),相关研究成果发表在Org. Lett.(DOI: 10.1021/acs.orglett.1c03225)。
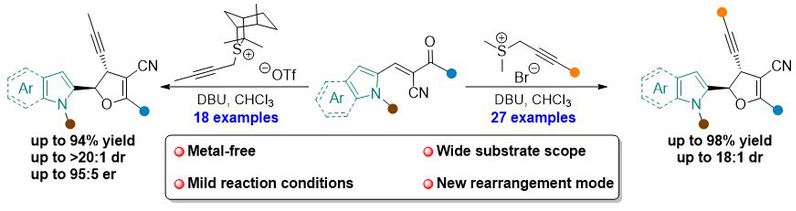
图1. 炔丙基锍盐作为C1合成子构筑2,3-二氢呋喃类化合物
(来源:Org. Lett.)
黄有教授课题组简介:

黄有教授课题组现有研究人员9人,包括教授1名,博士后1名,博士研究生3名,硕士研究生4名。目前课题组主要研究领域包括有机膦催化的Domino环化反应、硫叶立德参与的Domino环化反应、新型手性膦催化剂的设计合成及其不对称催化反应研究。该课题组已经在Angew. Chem. Int. Ed.、ACS Catal.、Org. Lett.、Chem. Commun.、Chem. Eur. J.等国际化学期刊发表论文100余篇。
黄有教授简介:
黄有,南开大学教授,博士生导师;1986年本科毕业于河南师范大学化学系,1997年于浙江大学获得有机化学博士学位;1997-1999年,在南开大学元素所进行博士后工作(合作导师:陈茹玉院士);1999-2002年,在大阪大学药学院从事博士后研究(合作导师:Hidenobu Ohmori 和 Hatsuo Maeda);2011年起,在南开大学化学院担任教授、博士生导师。黄有教授先后获得南开大学敬业奖教金教学二等奖、南开大学校级“教工先锋岗”先进个人、南开大学第五届“良师益友”提名奖等荣誉称号。
前沿科研成果:不对称串联Corey−Chaykovsky环丙化/Cloke−Wilson重排反应
硫叶立德最初由Johnson发现,后来Corey和Chaykovsky等人较为详尽地报道了硫叶立德在合成三元环中的应用。随着近些年研究的深入,多种硫叶立德和其前体锍盐被报道。黄有教授课题组长期致力于炔丙基锍盐的研究工作,不仅使用炔丙基锍盐作为C2合成子构筑了一系列五元单环或并环化合物(Org. Lett., 2017, 19, 412; Org. Lett., 2017, 19, 4664; Adv. Synth. Catal. 2018, 360, 438),还发展了其全新的反应位点(Org. Lett. 2020, 22, 5941)。在之前的工作基础上,黄有教授课题组希望能够进一步发展新的反应模式,作者注意到炔丙基锍盐中由于含有特殊的炔基官能团,能否使用其构筑复杂的炔烃类化合物。炔丙基锍盐在碱性条件下会生成高活性的联烯锍盐中间体,因此在以往的报道中更多是作为C2合成子参与反应,作为C1合成子参与的反应仅有两例报道。
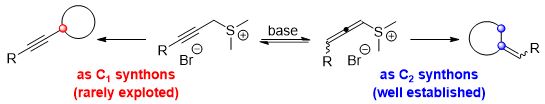
图2. 炔丙基锍盐的反应性
(来源:Org. Lett.)
在过去的数十年中,多个课题组报道了通过Corey−Chaykovsky环丙化反应构筑DA环丙烷,而DA环丙烷则可以通过Cloke−Wilson重排反应构筑二氢呋喃化合物。在这里,黄有教授课题组通过使用吲哚基团的去芳构化策略,实现了串联的Corey−Chaykovsky环丙化/Cloke−Wilson重排反应,以炔丙基锍盐与α,β不饱和酮为原料,一步构筑四取代二氢呋喃化合物。该工作发表在有机化学专业杂志Org. Lett.上(DOI: 10.1021/acs.orglett.1c03225),南开大学化学学院博士研究生周一鸣为第一作者。

图3. 串联构筑四取代二氢呋喃化合物
(来源:Org. Lett.)
作者首先用2-苯甲酰基-3-(1H-吲哚-2-基)丙烯腈1a与端炔锍盐2a为模板底物,分别对碱、溶剂等条件进行了初步筛选,然而仅能以60%的收率和6:1的dr值得到目标产物3a。这可能是由于端炔锍盐活性较高,存在其他副反应,当使用内炔锍盐2b时,反应收率明显提高。通过进一步优化后,作者发现CHCl3作为溶剂,DBU作为碱,室温下反应仅需1分钟,能以94%的收率和12:1的dr值得到目标产物。两种非对映异构体可以通过硅胶柱层析较好地分离。
aAll reactions were carried out with 1a (0.1 mmol), 2b(0.2 mmol) and base (0.2 mmol) in solvent (1 mL) at roome temperature unless otherwise stated. Isolated yields based on 1a. bDetermined by 1H NMR analysis. csulfonium salt 2a instead of 2b. dReaction temperature: 0 °C
表1. 条件筛选a
(来源:Org. Lett.)
在最优反应条件下,作者考察了该反应的底物普适性。从图4的结果可以看出,该反应具有很好的底物兼容性。针对不同取代的α,β不饱和酮和炔丙基锍盐,该反应过程都能够很好地进行,并以良好的收率得到相应的目标产物,克级实验的产率也能很好地保持。当使用烷基取代酮反应时,随着空间位阻的增大非对映选择性逐渐下降,这可能是由于在1,6-加成过程中,受空间位阻影响,10π共轭中间体难以转换到最佳构象。
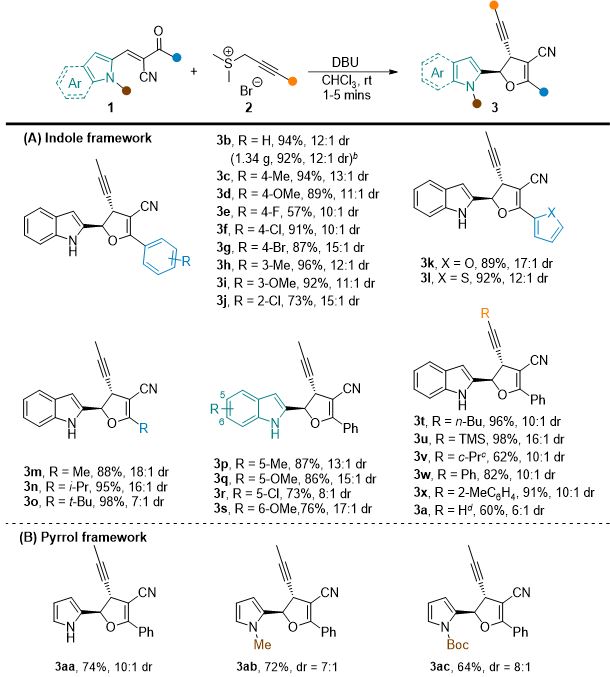
图4. 底物适用范围
(来源:Org. Lett.)
紧接着,作者进一步研究了该策略的不对称版本。从图5的结果可以看出,对于不同取代的底物都有很好的收率和对映选择性。
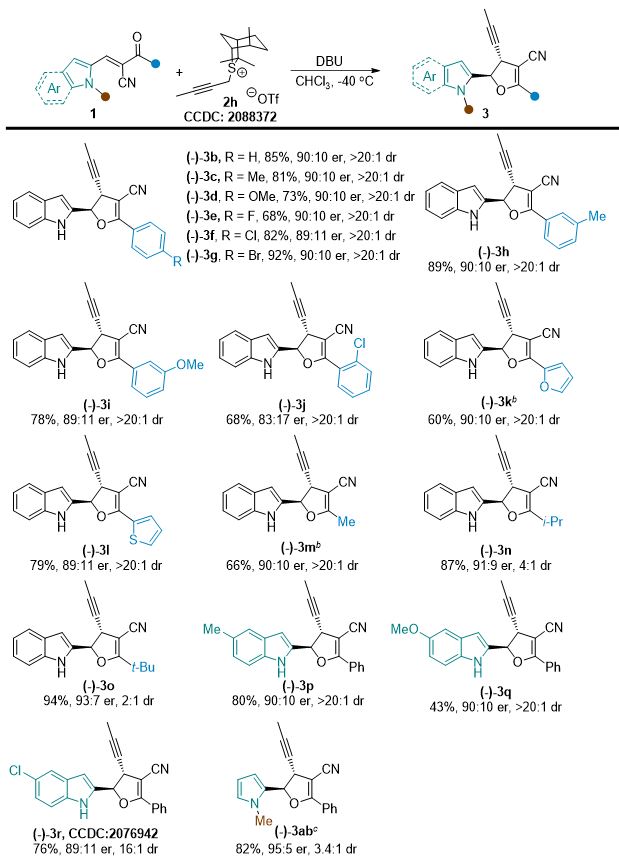
图5. 不对称版本底物适用范围
(来源:Org. Lett.)
为了证明该方法的实用性,作者进行了产物衍生化。图6结果表明,产物3b可以通过溴化、甲基化等方法来实现衍生化;还可以通过使用不同的催化剂实现炔烃的选择性氢化。产物3t可以在氟化钾作用下实现TMS基团的脱除得到端炔产物。
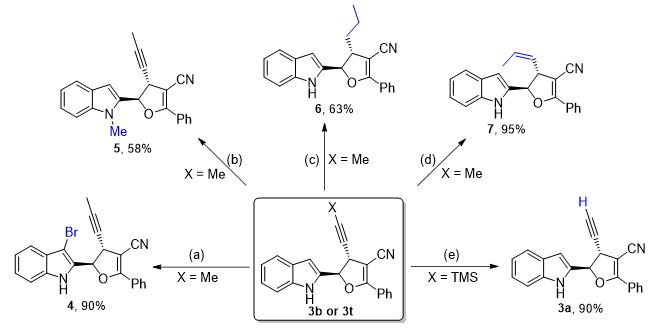
图6. 产物衍生化
(来源:Org. Lett.)
进一步,作者通过控制实验对该反应的机理进行了研究(图7)。首先,作者使用N-Boc取代底物1s和锍盐2b在标准条件下反应,成功分离得到了三元环产物8。之后将三元环产物在三氟乙酸作用下脱掉氮原子上的Boc保护基,并使用碳酸钠溶液淬灭反应,能够以1.5:1的dr值得到目标产物。可以看到作者在条件实验中使用碳酸钠作为碱时,同样以1.5:1的dr值得到目标产物(表1,序号7),该结果说明反应过程中首先经历Corey−Chaykovsky环丙化反应,同时非对映选择性由后续的重排过程控制。基于上述实验结果,作者提出了可能的反应机理:首先,锍盐2b在碱性条件下得到叶立德2b′,2b′进攻底物1a得到中间体A。中间体A再经历分子内亲核取代反应,脱去二甲硫醚得到三元环中间体B。紧接着B在碱性条件下依次发生去质子化和去芳构化过程,得到10π共轭中间体D,最后D发生分子内的1,6-加成和质子化得到目标产物。
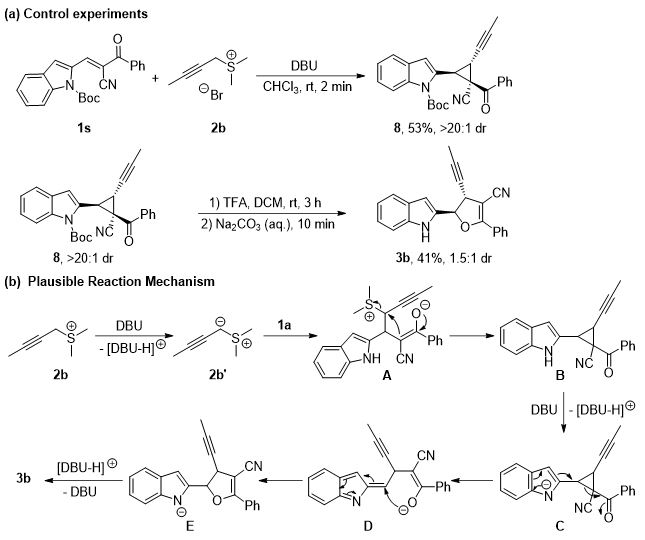
图7. 机理研究
(来源:Org. Lett.)
此外,可以看到当使用N-保护吡咯衍生物作为原料时,同样能够得到目标产物(图4B)。作者通过核磁监测发现反应过程中实际生成的是三元环中间体(对于无保护底物未监测到三元环中间体),但由于吡咯基团相对于吲哚基团具有更好的供电子能力,该中间体可以在硅胶作用下发生Grob类型重排反应,最终分离得到五元环产物(图8)。
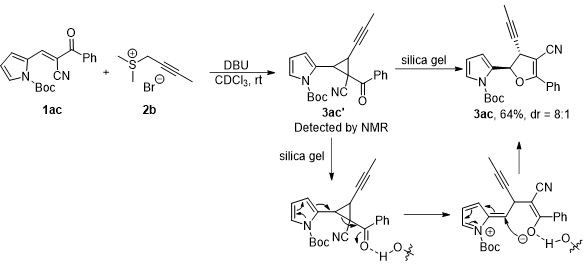
图8. 硅胶介导的重排反应过程
(来源:Org. Lett.)
总结:
该方法成功实现了炔丙基锍盐的不对称串联Corey−Chaykovsky环丙化/Cloke−Wilson重排反应,以高收率和立体选择性合成了多取代二氢呋喃化合物。作者通过吲哚骨架的去芳构化/分子内1,6加成过程,揭示了一种全新的开环/再环化策略。同时,这也是炔丙基锍盐首次作为C1合成子被应用于构筑复杂环系骨架,进一步扩宽了炔丙基锍盐的应用范围。该研究得到了国家自然科学基金委(21871148、21672109)资助。




