来源:X-MOL
吡啶结构广泛存在于药物分子、功能材料、催化剂配体中,因此,吡啶的官能化研究一直备受关注。由于吡啶有多个反应位点,以及吡啶环的缺电子性和强配位性,实现位点选择性官能化具有很大挑战。
由于氮原子的拉电子作用,增强了C2和C4位的亲电性,使其容易发生亲核取代反应,以Chichibabin反应(负离子亲核试剂)和Minisci反应(自由基亲核试剂)为代表的亲核取代反应是吡啶C2和C4位官能化的主要方式。吡啶C3位可以发生亲电取代反应(SEAr),然而,只有卤化和硝化等少数反应可行,且反应条件非常剧烈(强酸性、>300 ℃)。近期,过渡金属催化的碳氢键活化反应实现了吡啶C3位的多种官能化,但是这些反应大多使用大过量吡啶,且难以避免其他位置反应的副产物,降低了实用性(图1a)。因此,迫切需要开发一种通用且高效的策略实现吡啶C3位官能化。
南开大学王晓晨课题组长期致力于有机硼催化研究,发展了以五元并环和五元螺环为骨架的两类手性有机硼催化剂,并且实现了吡啶的串联还原、不对称串联还原等工作(Angew. Chem. Int. Ed., 2017, 56, 5817; Angew. Chem. Int. Ed., 2020, 59, 18452; ACS Catal., 2021, 11, 10824)(图1b)。基于上述工作,该课题组利用有机硼催化的吡啶硼氢化反应中产生的1,4-二氢吡啶中间体,通过引入亲电试剂,实现了吡啶C3位烷基化反应(图1c)。由于1,4-二氢吡啶的β位具有较强的亲核性,保证了取代反应的高活性和专一的位置选择性。反应对于各种取代的吡啶和亚胺均适用,还可以应用于多个药物分子的后修饰(图2)。而且,醛、酮、Eschenmoser盐等亲电试剂也适用。
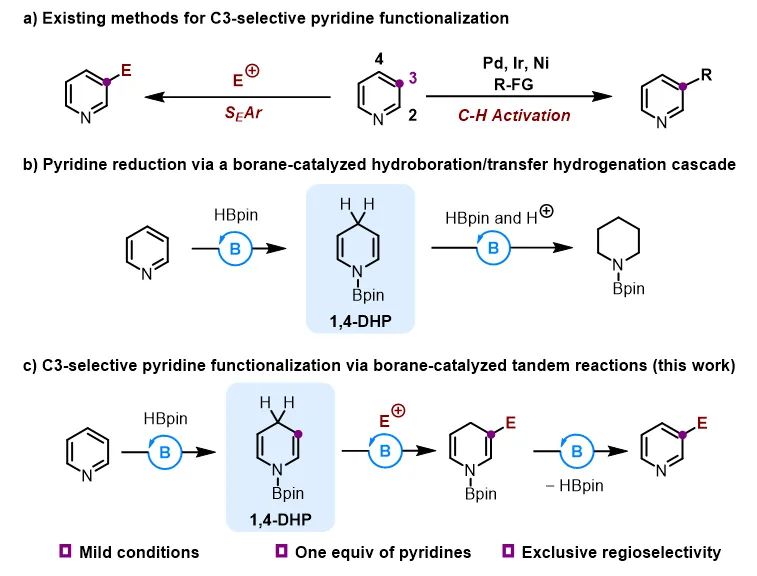
图1. 课题背景和设计思路
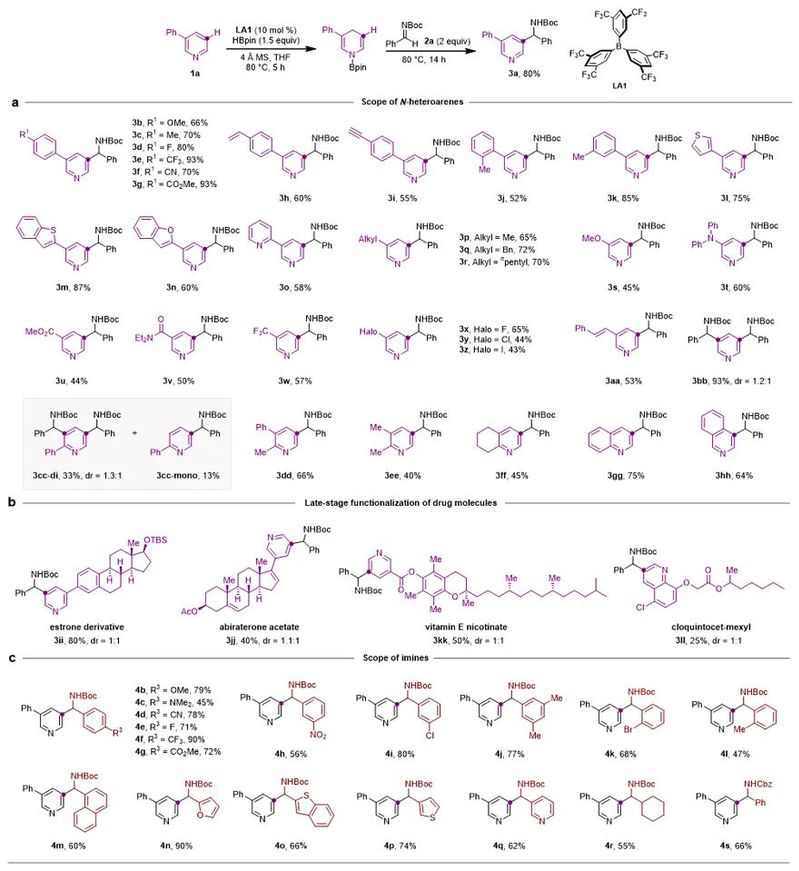
图2. 吡啶和亚胺底物拓展
作者通过控制实验和DFT计算发现,有机硼催化剂在反应中起到了三重作用:1)催化吡啶的硼氢化反应;2)活化亲电试剂,促进取代反应;3)催化转移硼氢化,实现氧化芳构化。此外,过量的亲电试剂在反应中作为负氢接收体,促进氧化芳构化。
总结
南开大学王晓晨课题组建立了吡啶C3位官能化的新策略,该策略适用于多种亲电试剂,而且,仅需一个当量吡啶,位置选择性专一,反应条件温和(最高80 ℃)。该方法为含吡啶药物分子的后修饰提供了一条便捷的途径。
原文(扫描或长按二维码,识别后直达原文页面):

Borane-Catalyzed C3-Alkylation of Pyridines with Imines, Aldehydes, or Ketones as Electrophiles
Zhong Liu, Jia-Hao He, Ming Zhang, Zhu-Jun Shi, Han Tang, Xin-Yue Zhou, Jun-Jie Tian, and Xiao-Chen Wang*
J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.2c00962
王晓晨
https://www.x-mol.com/university/faculty/63636
课题组网站
https://www.wangnankai.com/




