多肽分子由于其良好的生物兼容性和稳定的非共价作用,在构建生物医用功能材料领域广受关注。特别是在活细胞内通过酶催化组装、原位构筑多肽纳米结构是实现疾病检测与治疗的有效策略与前沿研究领域,近年来受到了广泛关注。然而,这一过程严重依赖酶的过表达,极大地限制该策略在疾病早期检测或细胞活性调控中的应用。
针对这一难题,近日南开大学余志林课题组在《J. Am. Chem. Soc.》期刊上发表了题为“Self-Amplifying Assembly of Peptides in Macrophages for Enhanced Inflammatory Treatment”的文章(DOI: 10.1021/jacs.2c01323),提出酶放大多肽组装的新概念,建立了基于多肽组装-酶表达放大关系的多肽组装新机制。通过多肽组装-酶表达放大关系,实现了正常酶水平下的胞内原位组装过程,为原位构筑生物医用功能材料提供了一种新策略。以炎症巨噬细胞中NADH-醌脱氢酶1(NQO1)为例,该课题组报道了巨噬细胞中多肽自放大组装行为,考察了该体系作为药物递送载体,表明了其在急性肺炎治疗中的增强抗炎作用。
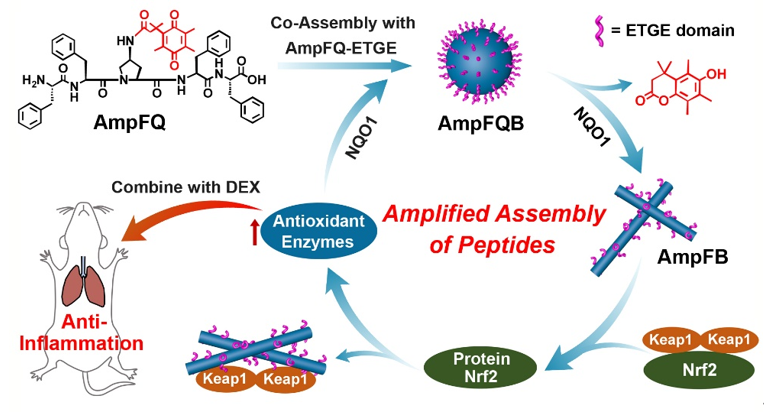
图1.巨噬细胞中与NQO1表达相关的多肽自放大组装示意图。图片来源:J. Am. Chem. Soc.
为了建立该体系,在前期多肽可控组装策略(J. Am. Chem. Soc. 2021, 143, 13854;Nano Today 2021, 38, 101198;Nano Lett. 2019, 19, 7965;Adv. Sci. 2019, 6, 1802043;J. Am. Chem. Soc. 2017, 139, 7823;Science 2016, 351, 497)及生物医用功能材料(Nano Lett. 2021, 21, 5730;Chem. Sci. 2020, 11, 1383;Nano Today 2020, 33, 100878)的研究基础上,余志林课题组设计并合成了醌丙酸修饰的五肽AmpFQ及其衍生物(AmpFQ-ETGE),其中ETGE序列源自Nrf2结构域。五肽AmpFQ可以被酶NQO1还原,形成具有良好组装能力的五肽AmpF。而其中的ETGE序列作为蛋白质Keap1的配体,促使Nrf2-Keap1复合物解离,激活Nrf2并促进NQO1表达。多肽AmpFQ与衍生物AmpFQ-ETGE共组装形成自放大组装体AmpFQB,NQO1酶对AmpFQB的还原导致形成对蛋白质Keap1具有高亲和力的纳米纤维,从而促进NQO1的表达。NQO1水平的提高反过来促进了多肽组装成纳米纤维,从而在多肽组装和巨噬细胞中NQO1表达之间建立了放大关系。
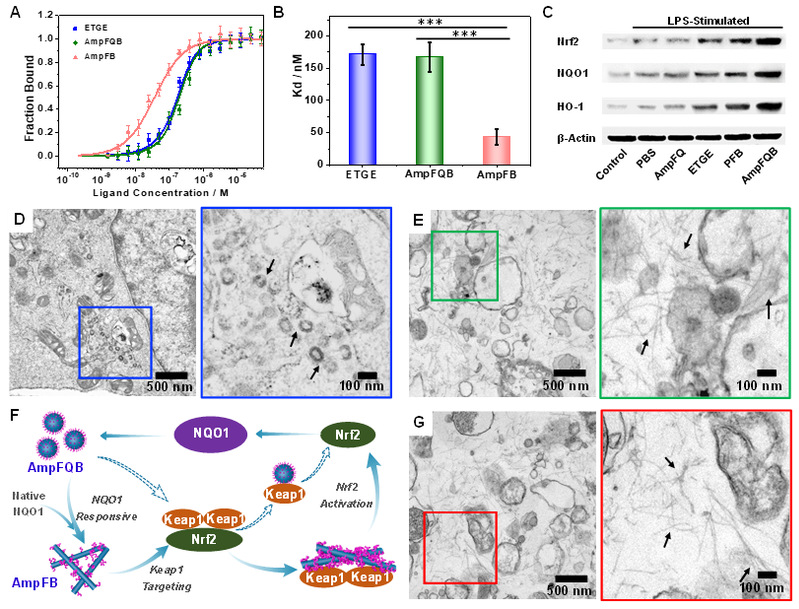
图2. 自放大组装体AmpFQB在巨噬细胞内实现酶表达自放大组装过程。图片来源:J. Am. Chem. Soc.
通过WB分析和生物电镜表征,作者们证实了自放大组装体系AmpFQB可以通过上调NQO1的表达实现巨噬细胞中多肽的自放大组装。在构建多肽自放大组装体系的基础上,作者们以多肽组装体为递送载体,考察了该体系在增强急性肺损伤常规药物抗炎治疗的能力。通过活体成像证明了AmpFQB具有增强的渗透性和滞留效应,可被动靶向急性损伤的肺部。而体外和体内研究均证实,自放大组装体系能够通过同时减轻ROS副作用和下调促炎细胞因子来增强地塞米松的抗炎功效。结合多肽的可靠靶向性,该体系将为未来精确有效地创建用于疾病诊断和治疗的超分子治疗剂提供一种独特的策略。
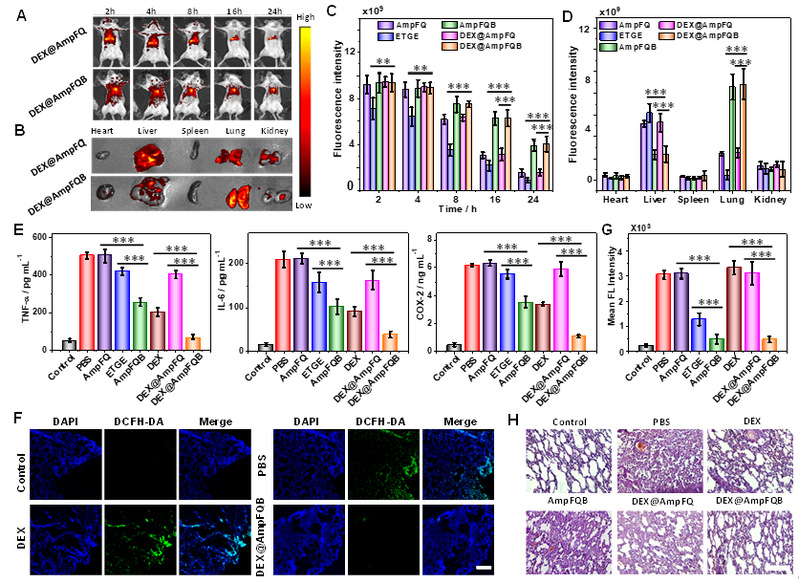
图3. 自放大组装体系DEX@AmpFQB的活体急性肺损伤抗炎治疗效果。图片来源:J. Am. Chem. Soc.
这一成果近期发表在J. Am. Chem. Soc.上,文章的第一作者是南开大学博士研究生宋艳秋,通讯作者为南开大学化学学院余志林研究员。该研究成果得到了国家自然科学基金委项目资助。
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.2c01323




