来源:X-MOL
肿瘤和新冠是目前全球面临的两大突出的健康威胁。大量研究表明肿瘤的发生和发展过程中会通过多种负反馈调节通路抑制免疫激活(如干扰素),进而逃避免疫监视;在新冠病毒的早期感染过程中也存在类似现象:新冠病毒借助多种效应组分来抑制干扰素等通路的激活,进而实现自身的感染复制,最终导致新冠肺炎。通过桥联固有免疫与适应性免疫,干扰素同时也在诱导病原特异性反应方面发挥着至关重要的作用。干扰素基因刺激蛋白(STING)是诱导干扰素分泌的中坚力量,已发展成为肿瘤治疗和新冠预防/治疗研究的重要靶标。作为激活STING分泌干扰素的天然激动剂,环二核苷酸(CDNs)目前在临床方面的应用效果不佳,主要原因是CDNs的稳定性差、跨膜性差以及在肿瘤、淋巴结等组织中渗透性不足等。
针对以上问题,清华大学李艳梅教授与南开大学郭东升教授、清华大学陈永湘副教授和中科院武汉病毒所张波研究员合作,发展了一种基于两亲性杯芳烃的STING激动剂递送系统-CASTING (CAlixarene-STING),作为一种新型的主客体前药配方,以解决 CDNs 的应用缺陷(稳定性差、跨膜性差和快速耗散等)(图1),增强CDNs的免疫治疗效率和新冠疫苗佐剂活性。超分子前药是基于刺激响应识别的药物递送系统,具有易于构建、分子级保护、定量加载、可控释放、重现性好和多药适应性等优点。
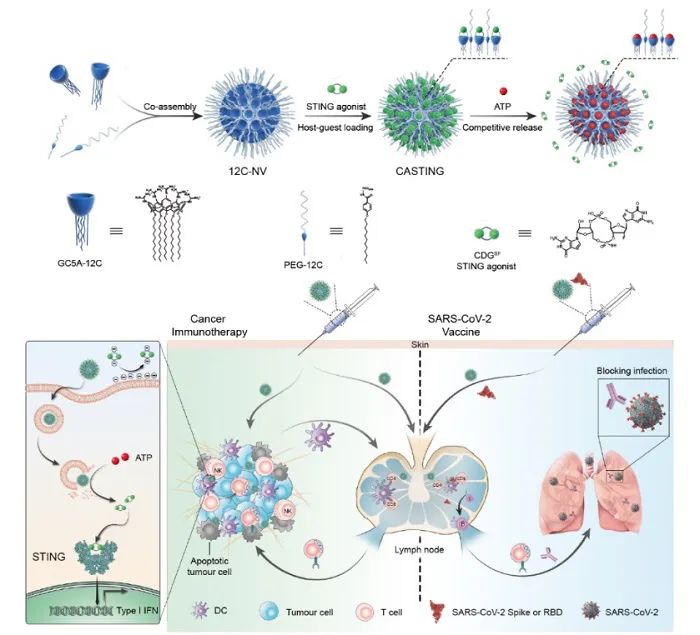
图1. 基于杯芳烃的STING激动剂递送体系-CASTING及其在肿瘤治疗和新冠疫苗制备的应用示意图
竞争性荧光滴定实验发现由杯芳烃GC5A-12C组装形成的纳米囊泡12C-NV与STING激动剂CDGSF(图2)之间存在非常强主客体结合力,达到 (1.0 ± 0.2) ×108 M-1,因而可以通过简单混合实现对CDGSF的定量负载(图2)。
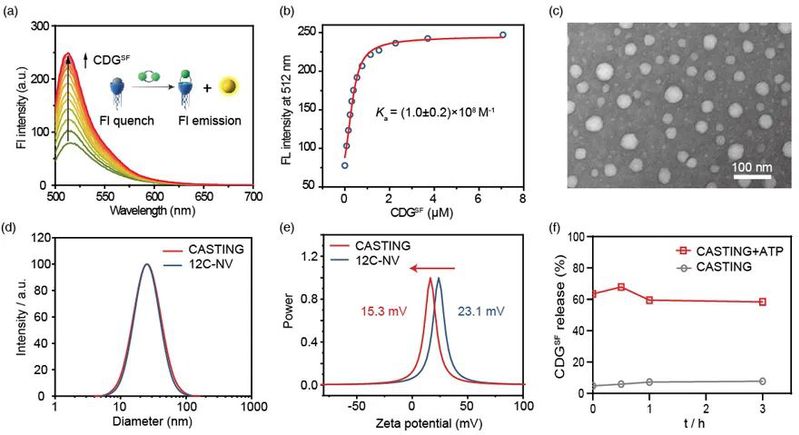
图2. 主客体结合力测定及CASTING的纳米特性表征
后续实验进一步发现杯芳烃纳米囊泡12-NV:一是可显著降低 CDGSF的酶促降解速率,二是通过表面胍基促进内含体逃逸,三是通过响应胞质中的ATP迅速释放 CDGSF。基于此,CASTING显着提高CDGSF 在多种细胞中的跨膜效率和免疫刺激活性;并在荷瘤小鼠中诱导产生了免疫原性肿瘤微环境,明显增强 CDGSF的抗肿瘤效率并提升黑色素瘤模型中anti-PD-1治疗的响应率(图3)。
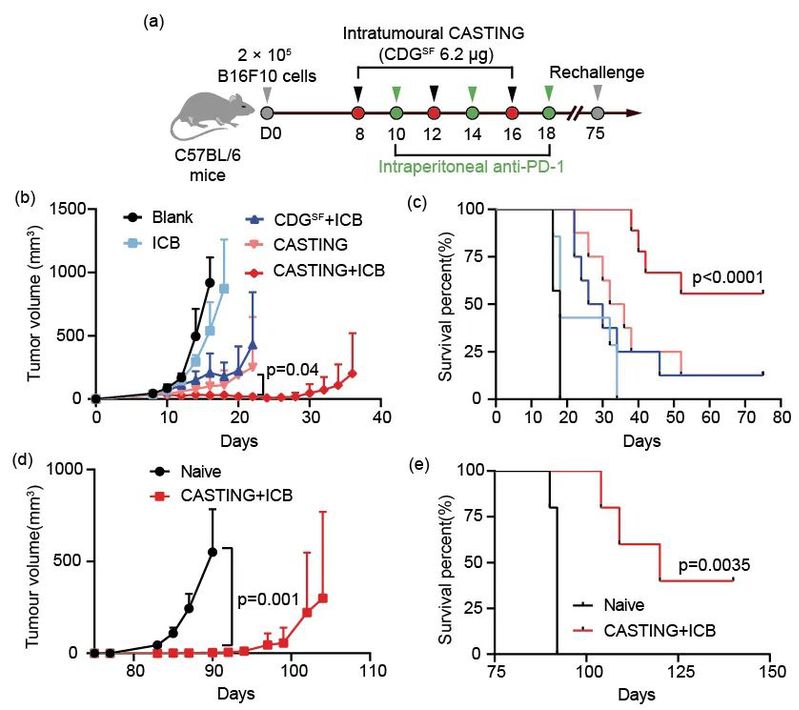
图3. CASTING与免疫检查点阻断(ICB)疗法联用可显著提高ICB的黑色素瘤治疗响应率,抑制肿瘤复发
此外,CASTING突出的纳米递送特性同时也有效提高了STING激动剂CDGSF在新冠疫苗制备中的佐剂活性,刺激产生了高水平的体液和细胞免疫反应,从而有效降低小鼠感染SARS-CoV-2后的病毒载量及减轻肺部病理变化(图4)。
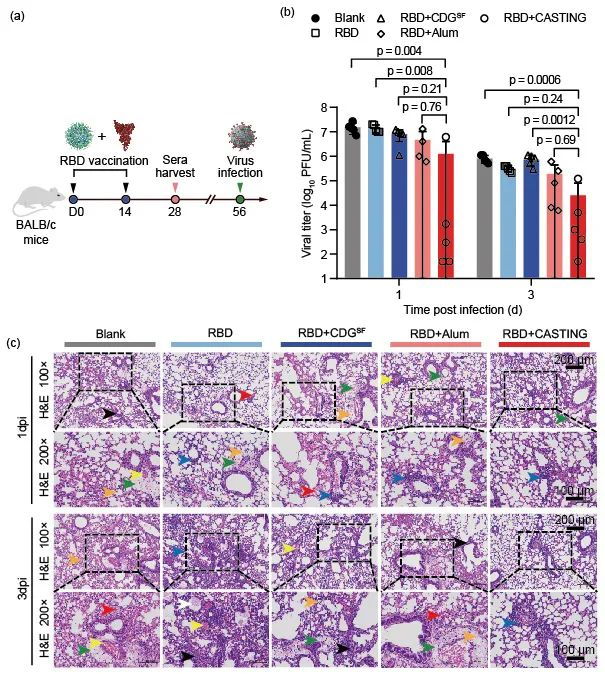
图4. CASTING作为新冠疫苗佐剂可显著增强疫苗的抗病毒保护效率(降低新冠病毒载量(b)、减轻肺部病理变化(c))
综上所述,该研究开发了一种新型的STING激动剂的超分子递送配方,可高效定量负载STING激动剂,响应性释放和改善胞质递送效率,进而显著增强了STING激动剂的免疫治疗效率和新冠疫苗佐剂活性。该设计策略同样适用于其他类型的STING激动剂,并且可能应用于其他类型肿瘤和冠状病毒的预防和治疗。
这一成果近期发表于中国化学会旗舰刊物CCS Chemistry,论文的共同第一作者是吴军军(目前就职于福建师范大学生命科学学院)、陈方远、韩贝贝和张宏庆。该研究工作得到国家重点研发计划、清华大学春风基金和国家自然科学基金等项目资助。
原文(扫描或长按二维码,识别后直达原文页面):

CASTING: A Potent Supramolecular Strategy to Cytosolically Deliver STING Agonist for Cancer Immunotherapy and SARS-CoV-2 Vaccination
Jun-Jun Wu†, Fang-Yuan Chen†, Bei-Bei Han†, Hong-Qing Zhang†, Lang Zhao, Zhe-Rui Zhang, Juan-Juan Li, Bo-Dou Zhang, Ya-Nan Zhang, Yu-Xin Yue, Hong-Guo Hu, Wen-Hao Li, Bo Zhang*, Yong-Xiang Chen*, Dong-Sheng Guo* and Yan-Mei Li*
CCS Chem., 2022, DOI: 10.31635/ccschem.022.202201859




