来源:CBG资讯
导语
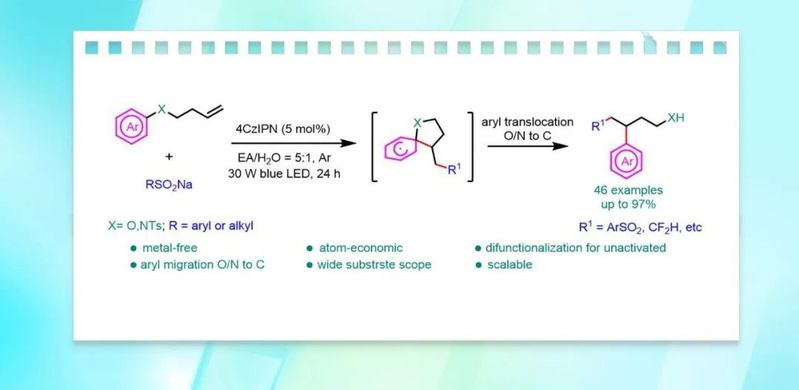
利用芳基迁移对烯烃进行双官能团化是很好的方法,该方法能快速合成具有多种官能团,且常规方法难以构建的高附加值化合物。近日,南开大学汪清民教授课题组报道了一种光催化芳基由氮或氧到碳的迁移对未活化烯烃砜基芳基化的反应。该反应将具有未活化烯烃的芳醚或芳香胺转化为具有芳基丙醇或芳基丙氨的结构,且该反应具有使用廉价的有机光催化剂,原子经济性高,官能团耐受性好等优点。相关研究成果发表于Green Chem.(DOI: 10.1039/d2gc03187f)。
前沿科研成果
光催化芳基由氮或氧到碳的迁移对未活化烯烃砜基芳基化
烯烃广泛存在于各种各样的医药、农药、聚合物和其他材料中。烯烃的双官能团化反应是增加分子多样性和复杂性的最有效的反应之一;利用芳基迁移的方法能够快速合成具有(杂)芳基骨架化合物,例如Smiles重排反应。将两种反应结合即利用芳基迁移对烯烃进行双官能团化能够快速合成常规方法难以构建的化合物。
近几十年来,研究人员对利用芳基迁移对烯烃进行双官能团化反应方面取得了突破性进展。Nevado、Greaney和其他课题组报道了Smiles-Truce重排反应的开创性工作,他们利用串联的重排反应将烯烃或炔烃衍生物转化为高功能化的杂环和(杂)芳基化合物(图1A)。Stephenson和朱晨课题组分别报道了烯烃的双官能化试剂,利用自由基Smiles-Truce重排对烯烃进行双官能团化(图1B)。
然而,这些反应依赖于磺酰基的存在,但大多数产物中的磺酰基在重排后都以二氧化硫的形式释放出来。研究人员也利用叔醇底物进行芳基迁移对烯烃进行双官能团化(图1C)。然而,叔醇底物的合成往往需要用芳基格式试剂或有机锂试剂。尽管利用芳基迁移策略对烯烃的双官能团化反应取得了重大进展,但设计和开发绿色的和经济的方法来完成芳基迁移对烯烃的双官能团化是有研究价值的。在此,作者报道了远端烯烃化的芳香胺或芳香醚,经过自由基加成和(杂)芳基迁移的串联过程对非活化烯烃进行双官能团化,并得到芳基丙胺和芳基丙醇的骨架(方案1D)。
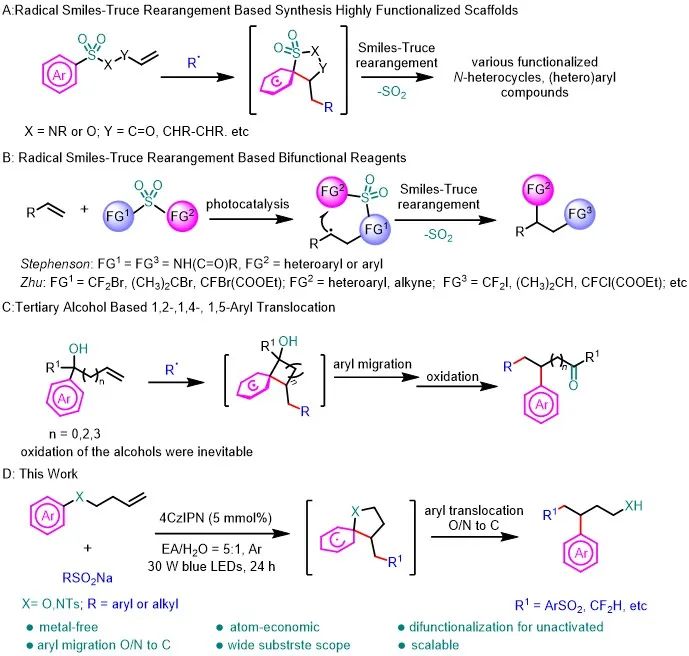
图1. 研究背景和工作总结(来源:Green Chem.)
首先,作者以1a作为模板底物,与对甲氧基苯亚磺酸钠(2a)反应,进行了相关反应条件的筛选(表 1)。当以4CzIPN(5 mol%)作为光催化剂,EA/H2O = 5:1(2 mL)作为混合溶剂,在30 W的440nm紫外灯照射下室温反应24 h,即可以93%的分离收率获得产物3a。
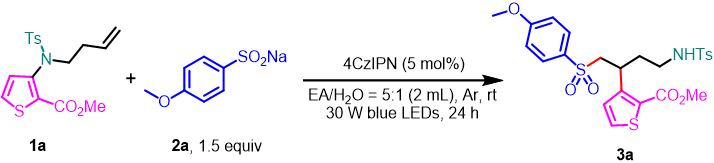
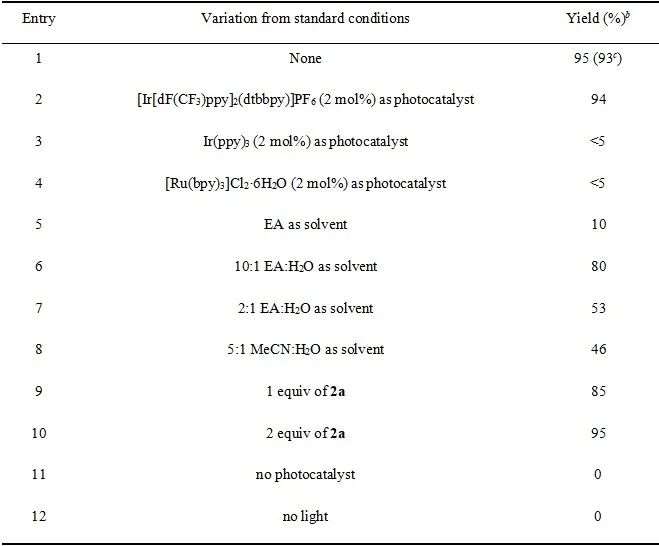
表1. 反应条件的筛选(来源:Green Chem.)
筛选出了反应的最优条件以后,作者对芳香胺的范围进行了探索。发现1a和位置异构体1b与4-甲基苯亚磺酸钠反应生成目标产物3b和3c,收率分别为96%和94%。噻吩环的4位和5位上有不同烷基取代基的底物也能以高收率获得3d-3f。同时氮原子上连接苯酰基和Boc基团也是可以容忍的 (3g和3h)。当迁移基团为多取代苯环时,产物3i的收率为92%。有趣的是,非芳香族烯胺衍生物也能进行反应获得相应的产物3j,收率为84%。不幸的是,当迁移基团是苯环或嘧啶时,没有得到相应的产物(3k和3l)。以上实验结果表明,该方法适用于缺电子的噻吩,也适用于邻位有给电子基团、对位有吸电子基团的苯环。这可能是因为新形成的烷基自由基是相对富电子的自由基。当底物中有邻位或对位吸电子取代基时,更容易进行烷基自由基加成。接下来,作者研究了与各种烯烃芳香醚的底物。含有各种迁移基团的芳基醚(噻吩和多取代苯环,包括色氨酸衍生物)都以中等至良好的收率获得目标化合物 (3m-3s)。作者通过改变溶剂,用CF3SO2Na和CF2HSO2Na作为自由基前体,成功将三氟甲基和二氟甲基引入底物中(3t-3x)。同时作者用含氟卤化物作为自由基前体,通过XAT的策略,以中等收率将含氟基团加成到烯烃上(3y-3ab)。
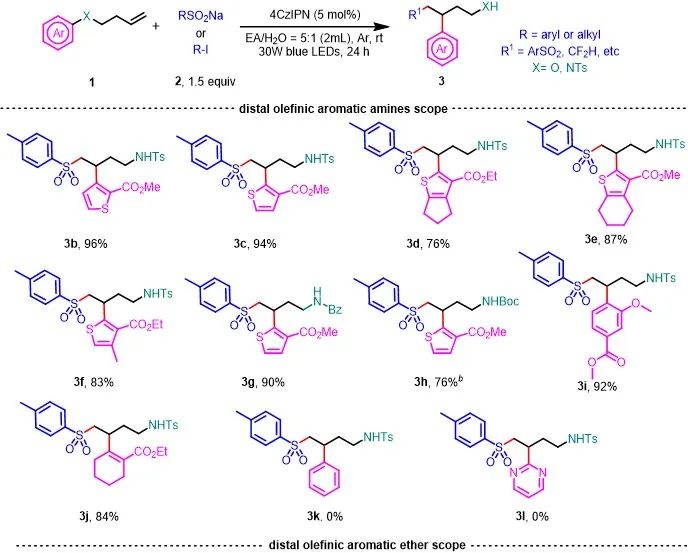
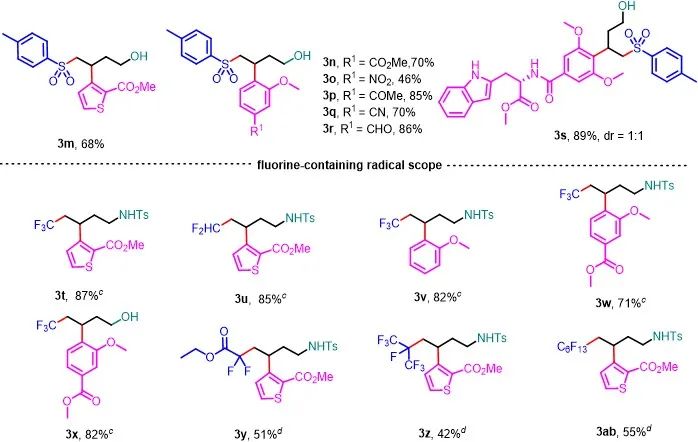
图2. 底物拓展1(来源:Green Chem.)
接下来,作者考察了各种芳基亚磺酸钠自由基前体。在邻位、间位和对位上具有吸电子基或给电子基的芳基亚磺酸钠与1b反应,得到相应的产物(4a-4n),产率为47-97%。萘亚磺酸钠以及联苯亚磺钠都以高收率获得目标化合物(4o-4q)。此外,乙基亚磺酸钠也能得到预期的产物4r,收率50%。同时,杂芳基亚磺酸钠也可以进行很好的反应(4s-4u)。
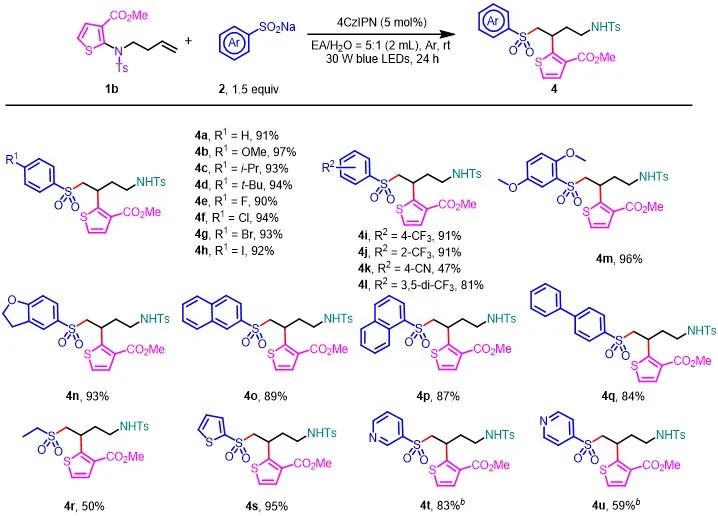
图3. 底物探索2(来源:Green Chem.)
为了进一步证明该方法的合成实用性,作者对该反应进行了克级制备,在6 mmol的规格下,以96%的收率得到了3c(图4A)。同时作者利用该方法对曲美布汀的衍生物进行了后期修饰,以93%的收率获得目标化合物5(图4B)。最后,为了证明该反应潜在应用价值,作者对产物3h进行转化,合成药物中间体6。
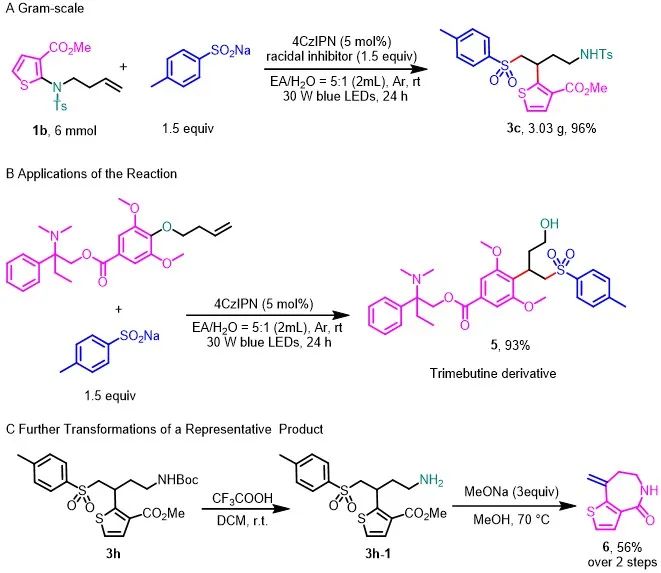
图4. 反应的应用(来源:Green Chem.)
随后,作者对该反应的机理进行了探索(图5)。首先,在模板反应体系中加入1.5当量的自由基抑制剂TEMPO或1,1-二苯乙烯时,反应受到抑制;同时,通过高分辨质谱捕获到自由基加成产物3ab的生成,表明该反应是自由基的过程(图5A)。当1a(0.1 mmol)和1m(0.1 mmol)与4-甲基苯亚磺酸钠(0.3 mmol)反应时,只有3b和3n生成,收率分别为94%和83%(图5B)。这一结果表明该反应涉及分子内重排过程。
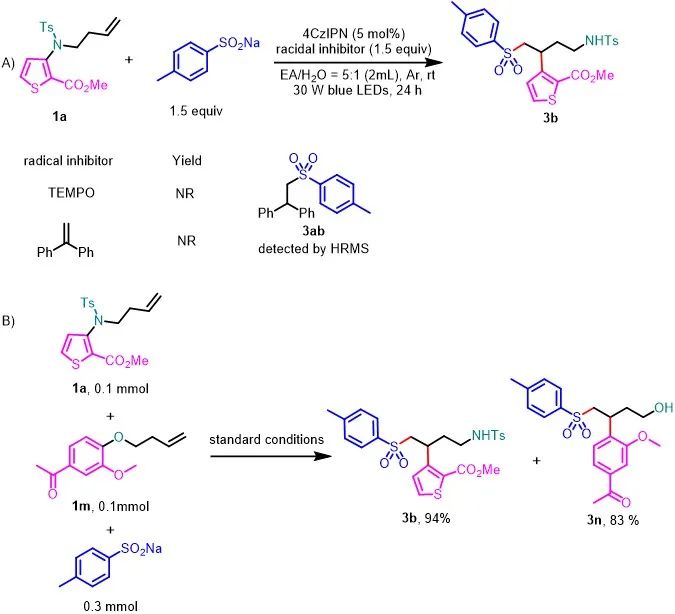
图5. 机理实验研究(来源:Green Chem.)
根据实验结果,作者提出了该反应的可能机理(图6)。首先,4CzIPN在440 nm的光照下跃迁到激发态。激发态的光催化剂是一种强氧化剂,与ArSO2Na 经单电子转移,生成磺酰基自由基和4CzIPN·-。随后,磺酰基自由基可与烯烃1反应生成新的烷基自由基中间体(I),杂芳基立即捕获中间体I,再经Smiles-Truce重排,从而生成中间体III。最后,中间体III可与还原性的光催化剂4CzIPN·-发生单电子转移反应生成目标产物IV,并再生成4CzIPN,从而完成催化循环。
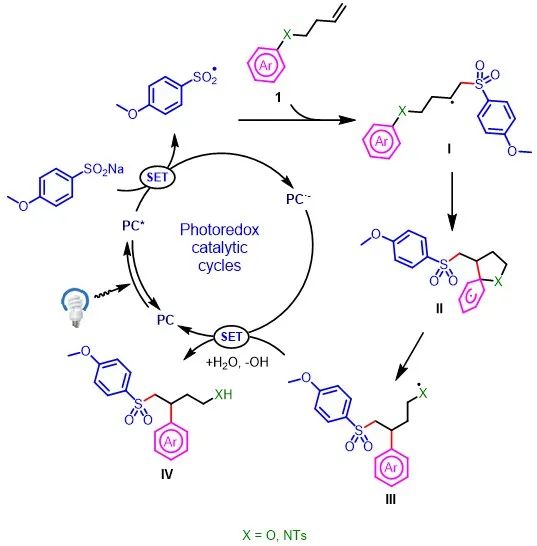
图6. 可能的反应机理(来源:Green Chem.)
总结:
作者开发了一种可见光诱导未活化烯烃砜基芳基化反应的方法。该方法具有良好的官能团耐受性,使用无金属有机光催化剂,具有原子和步骤经济的优点。该方法可将芳香醚和芳香胺转化为芳基丙醇和芳基丙胺,为药物分子官能团转化和新药开发提供了新的工具。
本篇工作通讯作者为南开大学的宋红建副研究员和汪清民教授。南开大学硕士研究生曹云鹏为该论文的第一作者,硕士研究生史晓迪、博士王欣谋和博士研究生张铭君对该工作做出了贡献。上述研究工作得到了国家自然科学基金(Nos. 21732002、22077071)和南开大学有机新物质创造前沿科学中心(No. 63181206)的资助。
原文(扫描或长按二维码,识别后直达原文页面):

汪清民课题组简介

南开大学汪清民课题组隶属于南开大学元素有机化学国家重点实验室和化学学院及天津化学化工协同创新中心。目前课题组拥有老师和研究生20多人。研究方向为生态农药、药物创制及环境友好的绿色合成反应。承担科技部、国家自然科学基金委、教育部、天津市等各种科研项目四十多项。先后在J. Agric. Food Chem.、Pest Manag. Sci.、Sci Adv.、Angew. Chem. Int. Ed.、ACS.Catal、 Chem. Sci.、Green Chem.、ChemSusChem.、ACS Sustainable Chem. Eng.、Arthritis & Rheumatism、J. Med. Chem.、Org. Lett.、Chem. Commun.等杂志上发表论文300余篇,申请了100多项中国和美国及欧洲等发明专利,已授权80多项中国和美国及欧洲等发明专利,出版著作4部(章)。发明了仿生农药拟除虫菊酯系列产品和重大农药品种及高端精细化学品的清洁生产新方法,已成功应用于工业化大生产,产生了巨大的经济效益。创制了多个超高效的植物病毒病防治药剂、绿色杀虫杀螨剂候选品种以及国家Ⅰ类新药,处于产业化开发的不同阶段。培养毕业了30多名博士生和50多名硕士生,毕业研究生获得了全国优秀博士学位论文提名奖、天津市优秀博士学位论文、南开大学优秀博士学位论文、南开大学优秀硕士学位论文和国家奖学金等。




