来源:CBG资讯
导语
β,γ-不饱和酮广泛存在于许多重要的药物活性分子和材料中,高效构建这种高价值的β,γ-不饱和酮是十分必要的。近日,南开大学汪清民教授课题组在这一领域取得重要突破,通过光氧化还原催化,氢原子转移催化与N杂环卡宾催化相结合,在没有烯烃异构化的情况下实现了烯丙位的直接酰基化,从而获得了一系列的β,γ-不饱和酮产物。相关研究成果发表于Nature Communication(DOI: 10.1038/s41467-023-38743-8)。
前沿科研成果
高效合成β,γ-不饱和酮
α,β-不饱和酮是功能有机分子中常见的结构,并且易于合成;相反,其异构体β,γ-不饱和酮的成熟合成方法却发展得少得多。鉴于它们存在于许多天然产物中,并可以作为基础结构单元来构筑复杂结构,其合成对多个领域都有十分重要的意义(图1a)。一般来说,以往的方法常基于羰基α,β键的断裂,即烯醇化物或烯醇化物等价物的α-烯基化;而羰基与其α位的断裂,即酰基供体的烯丙基化发展的比较少。而且,大多数方法仅限于相对简单的目标化合物,并容易发生质子重排得到α,β-不饱和酮。为了解决这些问题,近些年来发展了一些温和的催化反应。例如,Helquist课题组报道了利用卤化乙烯镍催化酮的直接α-乙烯基化(图1b上),Fu课题组报道了镍催化的α-溴代酮与乙烯基锆试剂的对映选择性交叉偶联(图1b下)。MacMillan课题组报道了利用铜/胺共催化体系进行醛的α-乙烯基化以得到对映选择性的β,γ-不饱和醛(图1c)。但是这些方法的断键方式集中于羰基α,β键的断裂,通过自由基的模式断裂羰基的α位进行逆合成几乎没有人报道过。因此,开发促进β,γ-不饱和酮合成的新方法仍然是有机化学合成领域面临的重要挑战之一,也越来越需要开发新的C−H键活化和以非传统方式进行的后期官能团化反应。
N-杂环卡宾催化剂(NHC)是一种独特的Lewis碱性催化剂,利用极性反转的手段来介导各种有机转化。光催化和电合成的复兴加速了自由基化学的发展,将可见光催化与N-杂环卡宾(NHC)催化结合起来,就可以在温和条件下实现N-杂环卡宾介导的自由基反应。到目前为止,基于单电子氧化醛和NHC生成的布雷思洛中间体得到自由基用于进一步反应已经由Scheidt、Studer、Chi、Rovis、Sun、Ye、Ohmiya和其他一些课题组报道过,而基于单电子还原酰基唑嗡中间体用于自由基反应只有较少探索。在这些过程中,NHC催化循环与第二个催化循环交织在一起,而生物体系中复杂天然产物的构建也通常通过多重催化的方法进行,因此,基于组合三种或更多种不同催化剂的多重催化对于开发新反应十分具有吸引力。然而,涉及NHC催化循环的三重催化仍处于起步阶段,其挑战在于各催化剂和中间体之间的兼容性问题,因此,作者旨在利用NHC独特的单电子还原特性和光催化、氢原子转移催化相结合,进一步弥合该领域的现有差距。
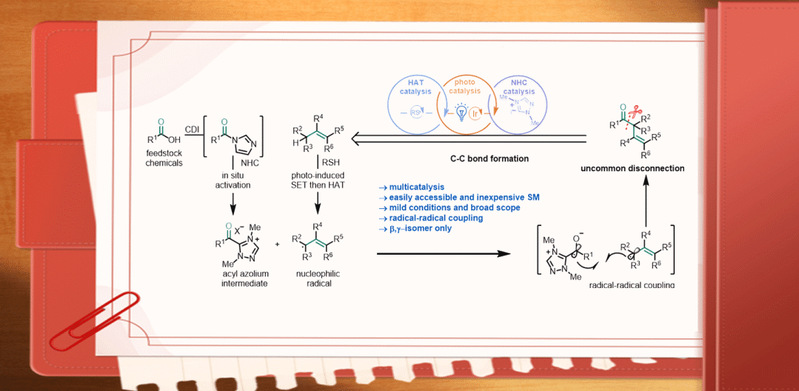
芳香羧酸廉价易得,具有较高的反应活性,是非常重要的化学合成基础原料,可用于快速填充复杂小分子库。作者报道了利用羧酸作为前体,通过光、NHC和HAT三重催化的模式,经由还原性单电子酰基唑鎓的烯丙基化反应,实现β,γ-不饱和酮的简便合成。作者设想羧酸在N,N'-羰基二咪唑作用下可以原位活化,之后加入N-杂环卡宾可以得到酰基唑鎓,该物种经过单电子还原将生成唑鎓自由基负离子。在可见光和光催化剂作用下,硫醇发生单电子氧化生成硫自由基;随后攫取烯烃烯丙位氢,生成烯丙位自由基;最后,唑鎓自由基负离子与烯丙基通过自由基偶联生成β,γ-不饱和酮(图1d)。该策略带来的主要挑战是:筛选三种高度选择性但相互独立的催化剂,使它们可以和谐地发挥作用。几个艰巨的挑战包括:(1)HAT催化剂必须区分反应物和产物;(2)硫基自由基可以选择性地进行HAT反应,而不是与羰基负离子自由基直接偶联;(3)必须避免形成α,β-异构体作为副产物;(4)由于三种催化剂的氧化还原活性是相互依赖的,基态光催化剂、NHC催化剂和HAT催化剂的再生需要三个催化循环的同步。
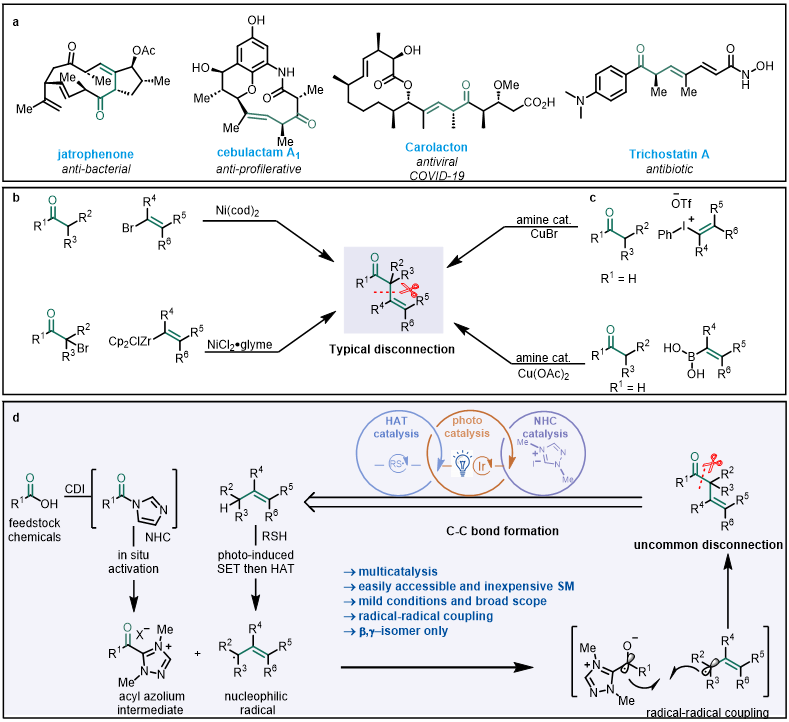
图1. 具有生物活性的β,γ-不饱和酮及其合成方法(来源:Nature Communication)
如表1所示,作者用对甲苯甲酸的酰基咪唑衍生物(1a)和环己烯(2a)作为模板底物对反应条件进行了筛选。在对光催化剂、NHC 催化剂、HAT催化剂、溶剂和碱进行了广泛筛选后,作者发现当使用PC-I(1 mol%)作为光催化剂,三异丙基硅基硫醇作为HAT催化剂,磷酸钾和碳酸铯作混合碱,二氯甲烷作溶剂氩气保护在蓝光灯照射下可以以77%的分离收率得到目标β,γ-不饱和酮产物3(entry 1)。使用其他光催化剂会导致产率降低(entry 2–4),NHC A通过相应的苯基唑中间体有效生成产物3aa的氮杂卡宾催化剂前体,所有其他测试的NHC前体都使产率大大降低(entry 5–9)。CH3CN和THF相比于DCM来说都不是最佳溶剂(entry 10–11)。对其他的HAT催化剂进行筛选,发现效果均不如三异丙基硅基硫醇(entry 12)。使用K3PO4作为催化量的碱得到了最优收率(entry 13–15),用NaHCO3或K3PO4代替Cs2CO3时,产率急剧下降(entry 16–17)。控制实验表明,在没有光催化剂、NHC 催化剂、碱或光的情况下,基本上不会产生任何产物(entry 18–22)。
表1. 反应条件的筛选a

aStandard conditions: 1a (0.3 mmol), 2a (0.6 mmol), NHC A catalyst (0.06 mmol), photocatalyst (0.003 mmol), Cs2CO3 (0.06 mmol), K3PO4 (0.06 mmol), and HAT-1 catalyst (0.06 mmol) in DCM (4 mL) were irradiated with blue LEDs under Ar at room temperature. bDetermined by 1H NMR spectroscopy with dibromomethane as an internal standard. NR, no reaction. cIsolated yield.
有了最佳的反应条件,作者对芳基羧酸的酰基咪唑衍生物进行了底物拓展(图2)。在与2a的反应中,反应的产率不受苯环上取代基性质的显著影响,在间位或对位具有给电子或吸电子基团的反应底物均能以中高产率得到相应β,γ-不饱和酮(4–20)。此外,对于邻位具有裸露羟基的底物,尽管产率中等,该反应依旧能够得到相应产物(21)。二取代的底物也适用于反应条件,得到化合物22–25。值得注意的是,卤素原子保持完整不会被还原,因此产物11–13、18、19和25具有用于进一步官能团化的反应位点。温和的条件使之与一系列官能团相容,包括苯基(6)、醚(7–10、16和24)、酯(17)和烷基取代的苯环(5、15、22和23)。此外,几种相对敏感但用途广泛的官能团如烯烃(9)和硼酸酯(14和20)也很好地耐受该反应条件,表明该方法在药物和合成化学中的潜在用途。由于药物中杂芳基的普遍存在,作者发现噻吩和吡啶底物也适用于该反应,分别以71%和38%的产率生成26和27。此外,2-萘甲酸衍生物也能够经历该转化,以69%的产率得到28。最后,对薄荷醇衍生物进行后期修饰,可以以41%的收率得到相应的产物29。
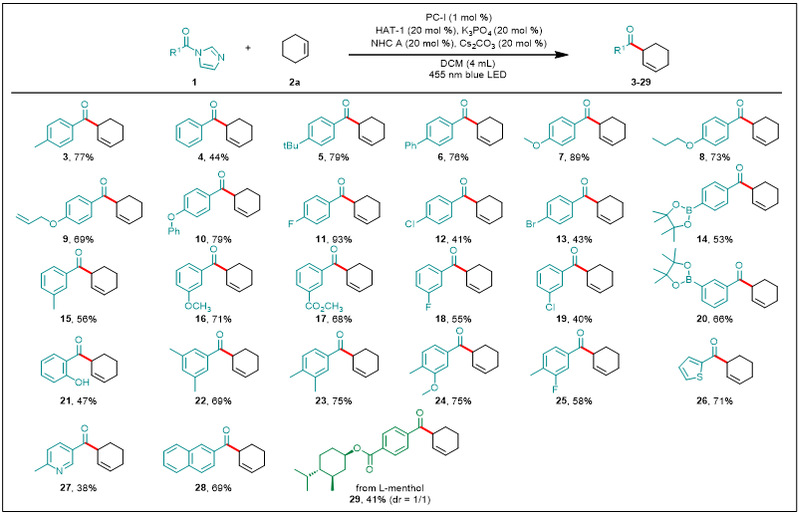
图2. 酰基咪唑的底物拓展a(来源:Nature Communication)
aReactions were performed on a 0.3 mmol scale under the conditions listed in entry 1 of Table 1.
反应条件也可以应用于具有多种取代模式和电子特性的烯烃2(图3)。环状和非环状烯烃都适用于这种转化。例如,从五元环到八元环一系列简单的环状烯烃均可以参与该反应生成相应的β,γ-不饱和酮(30–33)。而对于非环状烯烃而言,无论是长链烯烃或者短链烯烃、端烯或是内烯都能够作为反应底物以中等到良好的收率得到相应的产物(34–40),而且对于个别不对称取代的烯烃,可以分离得到异构体(37和37’)。由于邻位氧可以降低该位点的BDE值及其对自由基的稳定作用,可以很容易地解释苄基酰化而非烯丙位酰化产物(40)的生成。此外,一系列苄基Csp3−H底物已成功应用于该转化羰基烷基化。一级、二级和三级的苄基底物均可以66-77%的收率得到产物。最后,反应条件温和这一核心优点也在天然产物及活性分子的后期官能团化中得到了证明。例如,对于异蒲勒醇、乙酸松油酯、柠檬烯、3-蒈烯和双环戊二烯等食用香料进行酰基化,可以得到相应产物44–48,独特的位点选择性主要得益于空间位阻或更稳定的仲自由基。天然存在的γ-萜品烯具有多个烯丙基C(sp3)–H位点,该反应在环碳上选择性发生,以63%的产率产生产物49。用作靛蓝染料的丁二烯二聚体在两个位点进行直接烯丙基酰化,得到异构体的混合物(50)。此外,该方法还可以对具有杀虫活性的分子(S)-β-香茅醇的衍生物进行修饰,产物51的产率为49%。
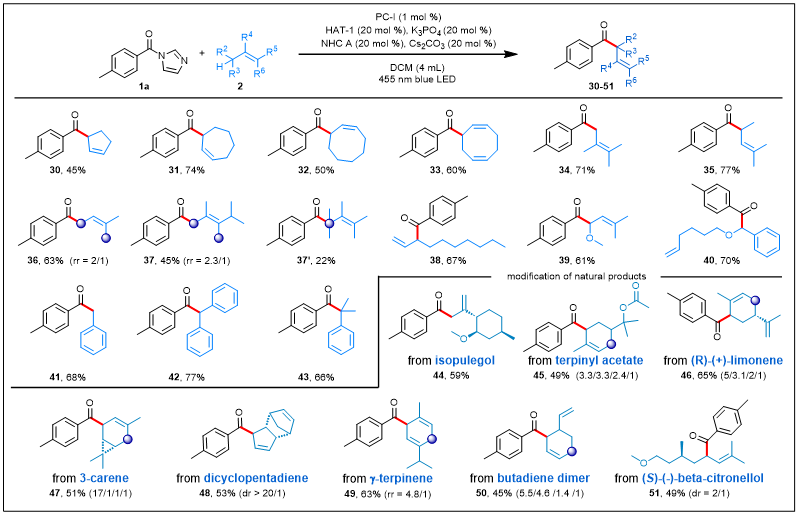
图3. 烯烃的底物拓展a(来源:Nature Communication)aReactions were performed on a 0.3 mmol scale under the conditions listed in entry 1 of Table 1.
为了证明该方法在合成上的应用(图4),作者对生成的高度官能团化的产物β,γ-不饱和酮3进行了克级制备和进一步的转化。如经由羟胺盐酸盐处理可以得到β,γ-不饱和酮肟52,该结构是非常有用和方便的异噁唑啉(53)合成原料。碳碳双键也能够被选择性还原得到54,末端烯烃55、β,γ-不饱和醇56和β,γ-不饱和的伯胺57可以分别通过Wittig反应、硼氢化钠还原和还原胺化反应得到。
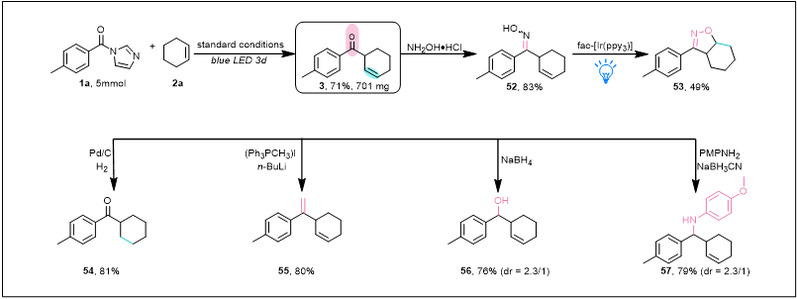
图4. β,γ-不饱和酮3的进一步转化a(来源:Nature Communication)aReactions were performed on a 0.2 mmol scale.
此外,为了证明该方法的简单性和实用性,作者直接从对甲苯甲酸合成了β,γ-不饱和酮3(图5)。使用CDI原位生成酰基咪唑,然后将其置于反应条件下能够以47%的收率生成3(而直接用酰基咪唑做反应底物得到的收率为77%)。而且苯甲酸、CDI 和环己烯也可以在标准条件下进行一锅反应以32%的收率得到3。

图5. 一锅法a(来源:Nature Communication)aReactions were performed on a 0.2 mmol scale.
接下来,作者对此光氧化还原体系的机理进行了探究(图6)。首先,利用2,2,6,6-四甲基哌啶氧化物(TEMPO)作为自由基捕获剂以确定反应是否通过自由基过程进行。该抑制剂完全抑制了3的生成,并且通过高分辨质谱检测检测到了2a和TEMPO的加成产物。此外,自由基捕获产物58可以从反应中分离得到,进一步支持了酰基自由基中间体的生成。值得注意的是,在环己烯2a存在下,直接使用酰基唑嗡类中间体59或59’在光氧化还原催化下可以直接生成产物3,收率为41%和25%,该结果表明:酰基唑嗡类中间体由酰基咪唑和NHC催化剂原位生成,应该是这种反应的中间体。接下来,作者进行了荧光-淬灭实验,中间体59和59’、硫醇(HAT-1)及去质子化的硫醇(int.I)作为淬灭剂对光催化剂PC-I进行了淬灭实验,结果表明,硫醇(黑线)以及中间体59(蓝线)和59’(绿线)均不能淬灭光催化剂,而碱存在下的硫醇(红线)可有效淬灭光催化。最后,开/关实验显示:反应在没有光的情况下完全停止,然后在照射时恢复,这表明光是必不可少的;即便有链式反应,也很短暂。
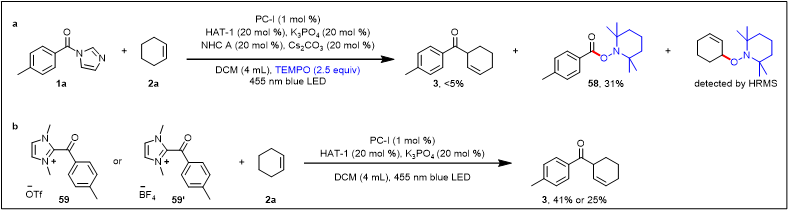

图6. 机理实验(来源:Nature Communication)
根据上述的机理实验和之前的文献报道,作者推测的光介导卡宾催化利用羧酸合成β,γ-不饱和酮的机理如图所示。在该机理中,作者提出的反应途径是:硫醇在碱的作用下去质子化生成硫负,被激发态的光催化剂(IrIII*)氧化生成硫自由基,之后攫取环己烯烯丙位的氢生成烯丙位自由基III。氮杂环卡宾催化剂和1a作用生成中间体IV,该中间体可以被单电子还原生成负离子自由基中间体V,之后和烯丙基自由基III发生偶联脱去氮杂卡宾生成相应的β,γ-不饱和酮。
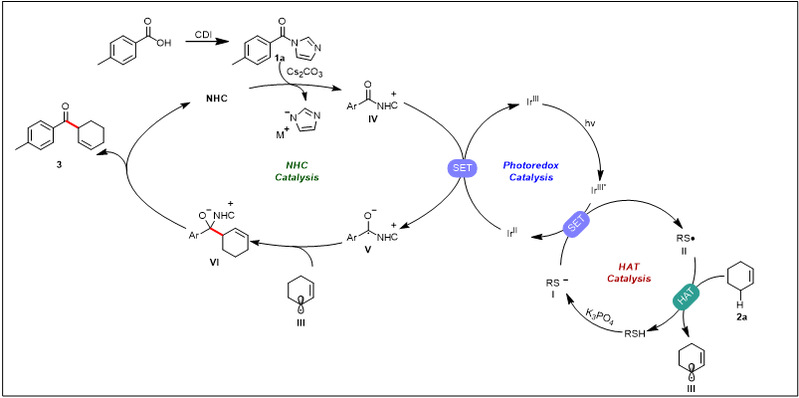
图7. 机理(来源:Nature Communication)
总结:
作者报道了一种利用酰基唑鎓物种的单电子还原反应以从羧酸制备β,γ-不饱和酮的方法。氮杂卡宾、光氧化还原和氢原子转移三重催化交织在一起的共催化模式使酰基唑鎓物种的单电子还原成为可能,随后的自由基-自由基偶联可以在温和的条件下轻松构建C-C键以生成β,γ-不饱和酮。该方法采用易于制备或市售的起始材料,具有广泛的底物范围和优异的官能团耐受性,天然产物和药物分子及其片段可以直接使用该方法进行偶联反应。得到的β,γ-不饱和酮产物也能够进行进一步转化。继续发展这种三重或多重催化一定能为氮杂卡宾介导的反应带来新的生机与活力。
本篇工作通讯作者为南开大学的汪清民教授。南开大学博士研究生王皛琛为该论文的第一作者。上述研究工作得到了国家自然科学基金的持续资助。
课题组简介

汪清民课题组全家福(2021.11.27)
南开大学汪清民课题组隶属于南开大学元素有机化学国家重点实验室和化学学院及有机新物质创造前沿科学中心。目前课题组拥有老师和研究生20多人。研究方向为生态农药和药物创制以及环境友好的绿色合成反应。承担科技部、国家自然科学基金委、教育部、天津市等各种科研项目40多项。在J. Agric. Food Chem.、Pest Manag. Sci.、Sci Adv.、Nat. Commun.、Angew. Chem. Int. Ed.、Chem. Sci.、Green Chem.、ChemSusChem.、ACS Sustainable Chem. Eng.、Arthritis & Rheumatism、J. Med. Chem.等杂志上发表论文300余篇。申请了100多项中国和美国及欧洲等发明专利,已授权80多项中国和美国及欧洲等发明专利。出版著作5部(章)。发明了仿生农药拟除虫菊酯系列产品和重大农药品种及高端精细化学品的清洁生产新方法,已成功应用于工业化大生产,产生了巨大的经济效益。创制了多个超高效的植物病毒病防治药剂和绿色杀虫杀螨剂候选品种以及国家Ⅰ类新药,处于产业化开发的不同阶段。培养毕业了30多名博士生和60多名硕士生,毕业研究生获得了全国优秀博士学位论文提名奖、天津市优秀博士学位论文、南开大学优秀博士学位论文、南开大学优秀硕士学位论文和国家奖学金等。




