来源:原位人

1、摘要简介
将氮氧化物(NOx)通过电化学硝酸盐/亚硝酸盐还原转化为氨是处理和利用NOx污染物的理想途径。在此基础上,纯相Fe3C纳米颗粒支持N掺杂碳纳米管催化剂展示了1034.9μmol h-1 cm-2的NH3产率和97.3%的法拉第效率,用于NO3-还原反应。Fe3C物种的优异本征活性归因于其卓越的吸附和活化NO3-的能力以及适当的活化质子能力。电化学原位FTIR光谱、原位拉曼光谱和密度泛函理论计算揭示了反应过程遵循一种新型多重反应路径。最后,提出了一个完整的从NOx到氨合成的演示装置,包括NOx收集、电化学硝酸盐/亚硝酸盐还原和氨收集,使得将绿色氨合成系统与分布式氮氧化物排放点相集成成为可能。
2、背景介绍
氮氧化物(NOx=NO+NO2)主要来自发电站、工厂和汽车的排放,被视为大气污染的重要来源。它们严重影响全球对流层化学,并成为温室效应、酸雨、光化学烟雾和PM2.5的主要原因。为应对NOx的严重危害,各国政府一直在出台越来越严格的立法和政策来控制NOx的排放。将NH3作为还原剂的选择性催化还原过程(NH3-SCR)已经得到商业应用。尽管这种NH3-SCR技术是解决NOx污染问题的可行方案,但伴随着巨大的能源消耗,对NH3的巨大需求以及对NOx资源的浪费。此外,湿式烟气脱硝作为一种利用酸或碱溶液吸收NOx污染气体的方法,也已经在工业上得到了应用。然而,从湿式烟气脱硝中得到的废液富含硝酸盐和亚硝酸盐,仍需要进一步处理。从能量的角度来看,NO3-和NO2-可以分解成低能的去氧化物种(204kJ mol-1)。因此,废液将成为通过电化学硝酸盐/亚硝酸盐还原合成氨的潜在氮源。
3、图文解析
根据图3a,与Fe@NCNTs和Fe/Fe3C@NCNTs相比,Fe3C@NCNTs展示了最高的NH3产率和法拉第效率(FE),并且NO2-的产率和FE相对较低。通常认为,当NO3-向NO2-的转化速率快于*NO2-到-NH3的转化速率时,会导致一些*NO2中间体从催化剂表面解吸并释放到电解液中成为NO2-产物。当然,随着反应的进行,生成的NO2-产物可以再次被吸附到催化剂上,然后经历随后的还原过程。但是,生成的NO2-产物的吸附-解吸过程通常会减缓整个NO3RR反应的速率。因此,NO2-产率被视为评估催化剂在NO3RR中电催化性能的重要指标之一。为此,研究了应用电位和反应时间对催化剂还原产物(NO2-和NH3)的产率和远效率(FE)的影响。如图3b、随着阴极电位的增加,Fe3C@NCNTs的NH3产率逐渐增加,并在-0.8 V vs RHE时达到1503.4μmol h-1 cm-2的高值,而NH3产生的FE表现出火山式的趋势,在-0.6 V vs RHE时达到97.3%的最大值。通过能量和效率的综合考虑,认为在这个系统中,-0.6 V vs RHE是Fe3C@NCNTs的最佳电位,其NH3产率为1034.9μmolh-1 cm-2。此外,Fe3C@NCNTs的NO2-产率和FE随着应用电位的增加而降低。为深入理解NO3-到NH3的反应过程,监测了-0.6 V vs RHE下30分钟的时间间隔内NO3-、NO2-和NH3的浓度变化(图3c)。电解液中NO3-浓度在15mM以上时,随着电解时间的增加,NO3-反应物的数量减少,呈负线性关系。这意味着Fe3C@NCNTs对较低浓度的NO3-具有强大的适应性。副产物NO2-的浓度首先增加(在2小时之前),然后减少(在2小时之后),但整个反应过程中保持在低浓度水平。由于NO3-离子的减少,竞争性HER将会增强。最终,生成的NH3的摩尔总量几乎等于初始摩尔量的NO3-,表明在Fe3C@NCNTs上的NH3选择性接近100%。进行了三个对照实验来确定产生的NH3的起源。更重要的是,本文Fe3C@NCNTs对NO3RR产生氨的电催化性能优于大多数最先进的非贵金属NO3RR电催化剂(图3d)。Fe3C@NCNTs被进一步研究了在-0.6 V vs RHE下进行NO3RR的连续回收电解。如图3e所示,在10个连续循环内,NH3的FE和产量率没有明显变化,显示出良好的稳定性。
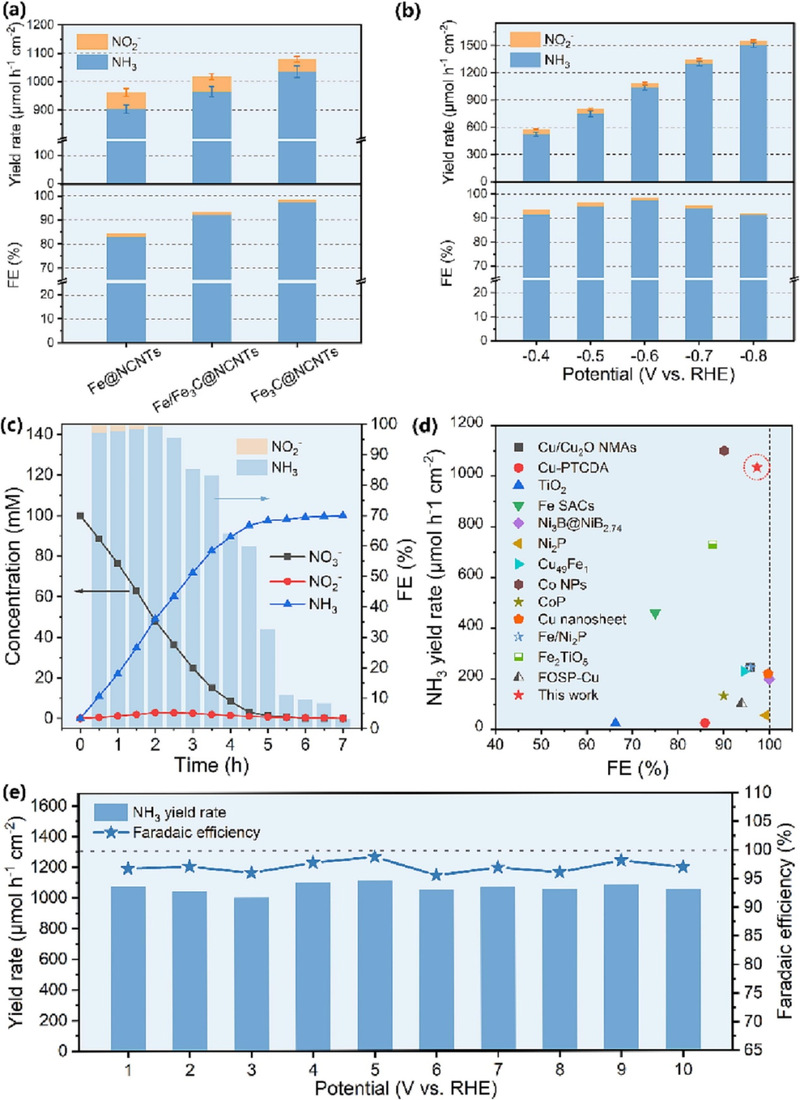
图3 (a)在1M KOH含100mM NO3-的条件下,制备样品的NH3产率和法拉第效率(FE)在-0.6 V vs RHE时的变化。(b)Fe3C@NCNTs在每个给定电势下的NH3产率和FE。(c)随着时间的推移,NO3-、NO2-和NH3的浓度变化以及Fe3C@NCNTs上相应的FE。(d)与报道的NO3RR催化剂相比,Fe3C@NCNTs的NH3产率和FE的比较。(e)经过连续回收电解1小时,在-0.6 V vs RHE时获得的Fe3C@NCNTs的NH3产率和FE
测试结果分析
正如图4c所示,一些吸收带随着时间逐渐加强,其中在1452cm-1处的常见带可以归属于NH4+的非对称弯曲振动,而1528和1632cm-1处的带则指示了吸附的H2NOH。这些FTIR吸收带的指认已在我们之前的报告中得到确认。在原位Raman光谱中(图4d),位于1139和1528cm-1处的两个信号分别对应于-NH2和-NH,它们的强度随时间增加,1050cm-1处的信号特征是NO3-离子。通过原位FTIR和原位Raman光谱监测到存在*H2NOH、*NH和*NH2中间体,意味着在NO3RR的反应过程中可能同时发生多条反应路径,包括N端路径和NO侧路径。
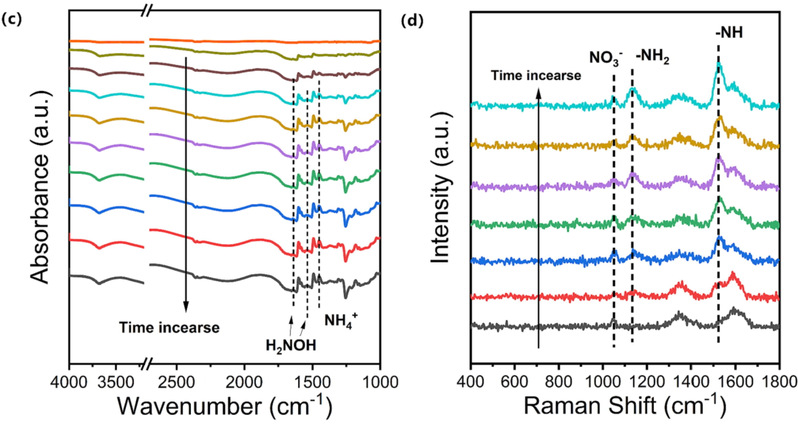
图4. (c) 电化学原位FTIR和(d) 电化学原位Raman随时间变化的光谱
原位实验细节
通过配备液氮冷却的MCT-A探测器的Nicolet 50和HORIBA XploRA PLUS,进行了电化学原位FTIR和原位拉曼光谱研究。
4、结论
总之,我们成功构建了电催化反应介导的演示装置,用于从氮氧化物污染中合成绿色氨。以N掺杂纳米管为载体的纯相Fe3C纳米颗粒被用作高效的还原硝酸盐到有价值氨的电催化剂。理论和实验表明,Fe3C物种对于NO3-还原成氨比Fe物种具有更高的内在活性。Fe原子和C原子的相互作用可以有效调节d带中心并调节Fe3C的电子结构。Fe3C表面吸附H质子的适当吸附容量可使H质子快速扩散到反应中间体,进一步进行加氢反应,这有效地通过抑制N-N和H-H偶联来提高产物选择性。从*NO到NH3的过程中,中间体的自由能差异很小,这使得在NO3RR过程中可能同时发生多条反应路径。自制的演示装置验证了从NOx到NH3的可行性以及将该技术整合到现有工业链中的可能性。本研究使模块化技术有潜力从重度NOx污染行业生产绿色氨。
原文链接:
R. Hao, S. Fang, L. Tian, R. Xia, Q. Guan, L. Jiao, Y. Liu, W. Li, Elucidation of the electrocatalytic activity origin of Fe3C species and application in the NOx full conversion to valuable ammonia, Chemical Engineering Journal (2023).
DOI:10.1016/j.cej.2023.143371
https://doi.org/10.1016/j.cej.2023.143371




