来源:水系能源

01 全文摘要
碘(I2)由于其在海洋中丰度高且成本低廉的独特优点,作为水系电池的活性材料显示出巨大的应用前景。然而,在传统的水系I2电池中,I-/I2转换的储能机制仅为双电子氧化还原反应,限制了其能量密度。在此,南开大学牛志强教授团队通过电解质中氧化还原离子电荷载体和卤化物离子的协同效应实现了I2电极的六电子氧化还原化学。电解质中具有氧化还原活性的Cu2+离子会在低电位下诱导Cu2+离子和I2转化为 CuI。同时,电解质中的Cl-离子在高电位下激活I2/ICl氧化还原对。因此,在本文的案例中,开发了具有六电子氧化还原的基于I2的电池系统。这种六电子氧化还原的储能机制引导I2电极具有高放电电位和容量、优异的倍率性能以及稳定的循环行为。令人印象深刻的是,六电子氧化还原I2阴极可以与各种水系金属(例如Zn、Mn和Fe)阳极匹配来构建金属||I2混合电池。这些混合电池不仅具有增强的容量,而且具有更高的工作电压,这有助于实现卓越的能量密度。因此,这项工作拓宽了高能水系电池设计的视野。
02 图文速递
图1:I2电极在水溶液中的不同充放电过程示意图
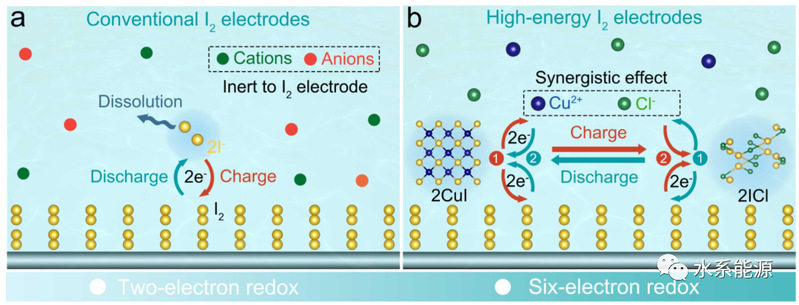
a)常规双电子氧化还原和b)六电子氧化还原。
图2:I2电极的储能机理
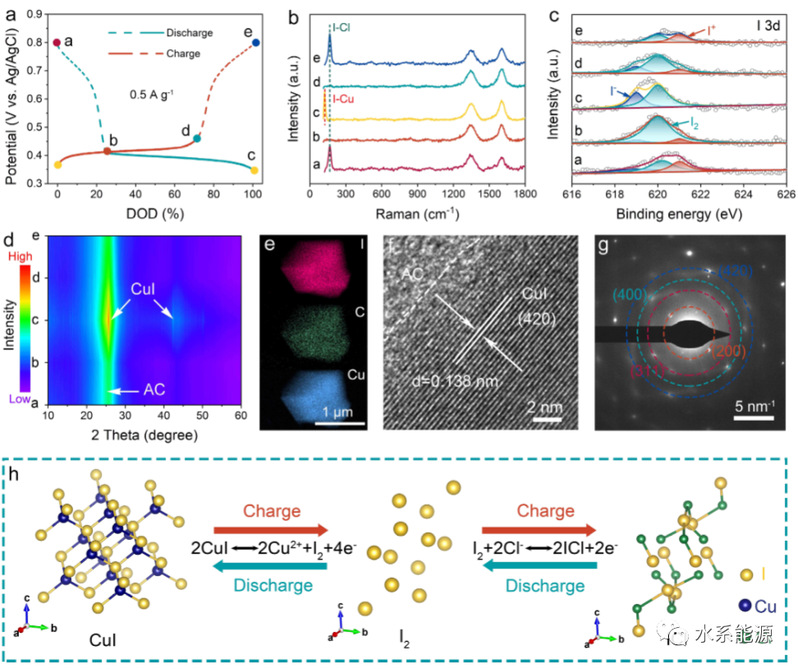
a)0.5 A g-1下第二条的GCD曲线,其中标记的状态用于机理分析。b)拉曼光谱,c)I 3d XPS光谱,d)不同充放电状态下的XRD图谱。e)TEM元素图,f)HRTEM和g)完全放电电极的SARD图像。h)充放电过程中I2的结构演变。
图3:I2电极在不同电解质中的电化学性能
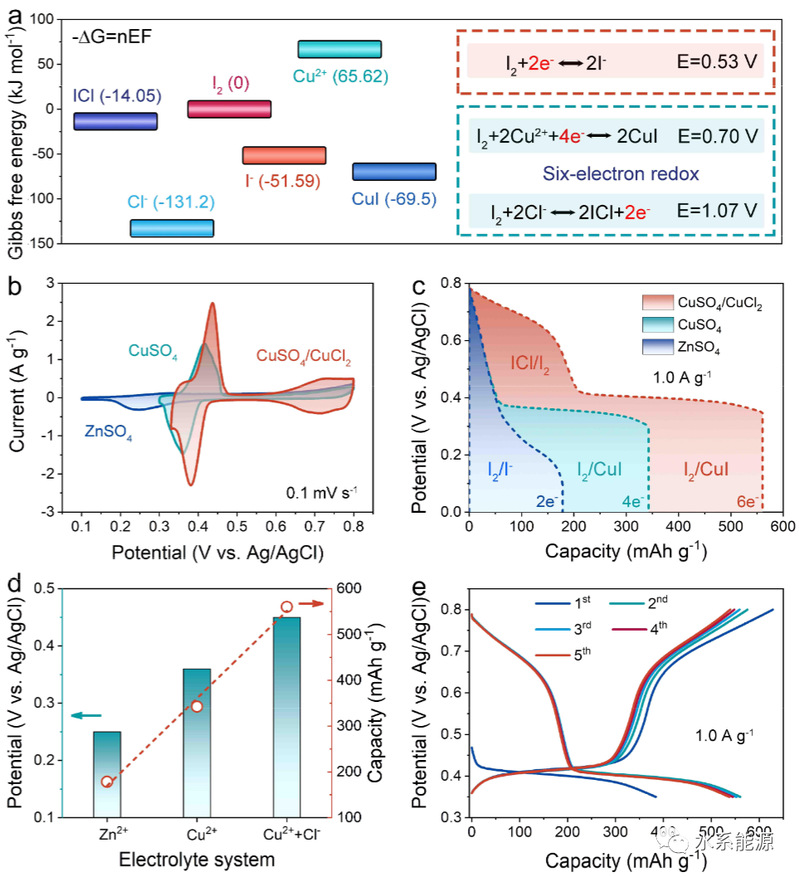
a)吉布斯自由能和计算得到的各种I2基氧化还原对的氧化还原电位。b)0.1 mV s-1时的CV曲线。c)1.0 A g-1时的放电曲线。d)1.0 A g-1放电容量和电势的比较。e)1.0 A g-1时CuSO4/CuCl2电解质的GCD曲线。
图4:六电子氧化还原I2电极的反应动力学

1.0~10.0 A g-1不同电流密度下的a)GCD曲线和b)循环性能。c)不同电流密度下六电子氧化还原I2电极与已报道的基于I2电极的容量比较。d)两个电位平台在不同电流密度下的容量。e)不同放电状态下的EIS光谱。f)不同扫描速率下的CV曲线。g)计算不同氧化还原峰的b值。h)0.5 mV s-1时的电容贡献。
图5:水系金属||I2混合电池的电化学性能
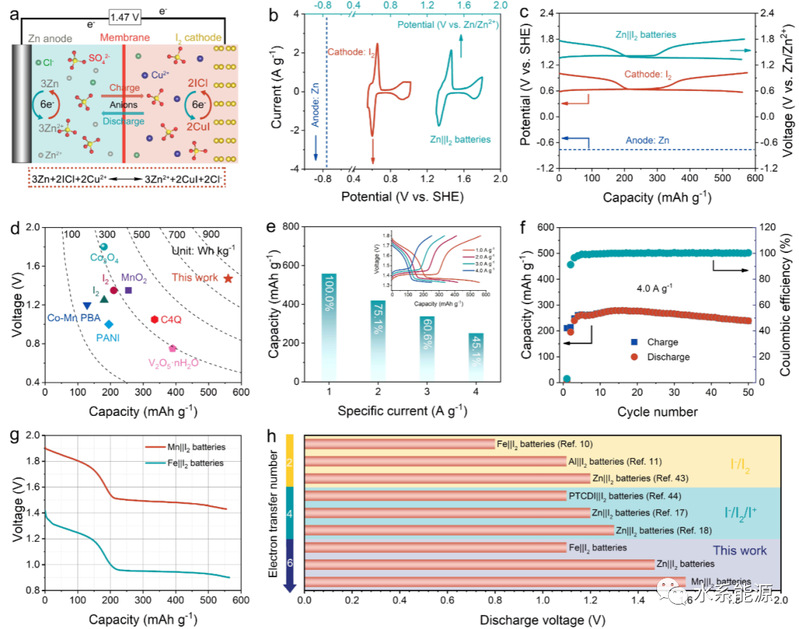
可充电Zn||I2混合电池:a)原理图;b)I2电极的CV曲线(0.1 mV s-1)和c)混合电池的GCD曲线(1.0 A g-1);d)与已有报道的基于普通正极材料的水系锌离子电池的放电电压和容量比较;e)不同电流密度下的容量(1.0~4.0 A g-1)和f)循环性能(4.0 A g-1)。(e)为不同电流密度下的GCD曲线。g)1.0 A g-1下Mn||I2和Fe||I2混合电池的放电曲线。h)不同水系I2电池的放电电压比较。
03 研究结论
综上所述,I2电极的六电子氧化还原化学是通过电解质中氧化载流子和卤化物离子的协同作用来设计的。氧化Cu2+离子载流子参与I2的氧化还原,在低电位充放电过程中传递四电子转移。I2/CuI氧化还原对不仅使I2/I-氧化还原容量翻倍,而且由于Cu-I键的形成,还提供了更高的氧化还原电位。此外,电解质中的Cl-离子通过卤素间的协同作用稳定了I+离子,从而实现了I2/I+的转化,导致了额外的双电子氧化还原。结果表明,Cu2+和Cl-离子的引入诱导了I2电极的六电子氧化还原反应。基于这种六电子氧化还原反应,I2电极的放电电位为0.45 V vs. Ag/AgCl,在1.0 A g-1下的容量为560.4 mAh g-1。为了说明六电子氧化还原I2电极在水系电池中的可行性,分别组装了Zn||I2、Mn||I2和Fe||I2混合电池。所有这些水系混合电池都显示出增强的能量密度。这项工作为高能水系离子电池的设计提供了一条途径。
04 原文链接
Six-electron-redox iodine electrodes for high-energy aqueous batteries
Songshan Bi,Huimin Wang,Yanyu Zhang,Min Yang,Qingjie Li,Jinlei Tian,Zhiqiang Niu*
https://doi.org/10.1002/anie.202312982




