来源:余志林研究员课题组
程序性细胞死亡(PCD)是一种典型的细胞死亡途径之一。在各种形式的PCD中,细胞坏死由受体相互作用激酶(RIPK)1和3介导,进一步招募混合系激酶结构域样假激酶(MLKL)并使其磷酸化,从而导致膜破裂和细胞死亡。因此,激活坏死信号通路被认为是克服因细胞凋亡通路失活而引起耐药性的一种潜在策略,然而仍缺乏特异性激活细胞坏死药物。针对这一难题,南开大学化学学院余志林课题组提出了一种异源多肽-蛋白质组装策略,通过发展激酶仿生D-逆反肽,通过仿生设计合成D-逆转肽(DRI-peptide),可以选择性促进激酶聚集,从而激活坏死信号通路、诱导细胞死亡。该研究展示了手性分子从纳米尺度调控蛋白活性的能力,为解决蛋白“不可成药”问题提供了超分子策略。近期,该成果以‘Artificial Peptide-Protein Necrosomes Promote Cell Death’为题,发表于《德国应用化学》上(DOI: 10.1002/anie.202314578),并入选VIP文章。
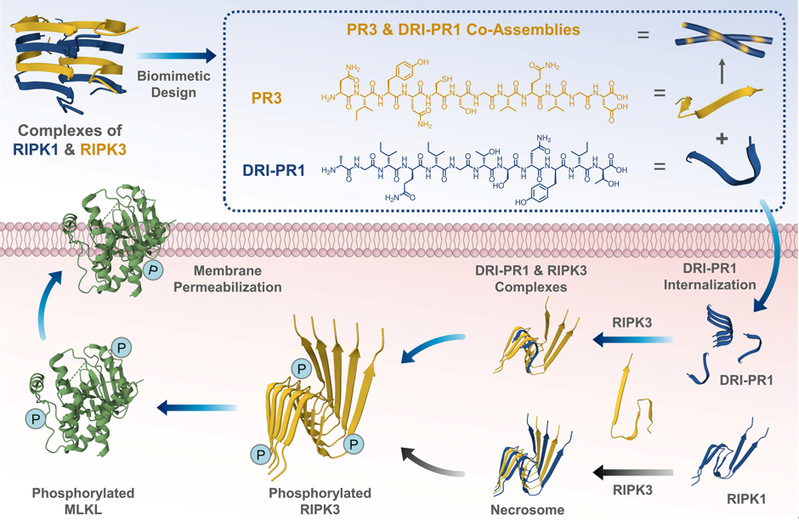
图1. 激酶仿生肽PR3和DRI-PR1的设计思路以及DRI-PR1在促进RIPK3聚集以激活坏死信号通路和细胞坏死的作用示意图。
近年来,通过合理定制序列的多肽自组装可以得到明确的纳米结构并开发复杂的生物医用材料的研究取得了飞速进展,并且在活细胞中组装多肽可以通过配体与受体的相互作用来操控蛋白质活性。该工作受RIPK1和RIPK3形成的天然坏死体结构的启发,通过使用天然氨基酸或D-氨基酸,或以反向逆转方式连接D-氨基酸(DRI),合理设计激酶仿生肽,从而产生了一种RIPK3仿生肽PR3和三种RIPK1仿生肽。DRI-PR1仿生肽可以诱导RIPK3磷酸化增加,阐明细胞坏死信号通路激活,从而凸显了多肽-蛋白质异质聚集作为一种有前景的癌症治疗方法的潜力。溶液中的共组装实验表明,RIPK1-仿生肽与PR3混合可显著加速并增强PR3的组装,从而为活细胞内的多肽-蛋白聚集提供了基础。
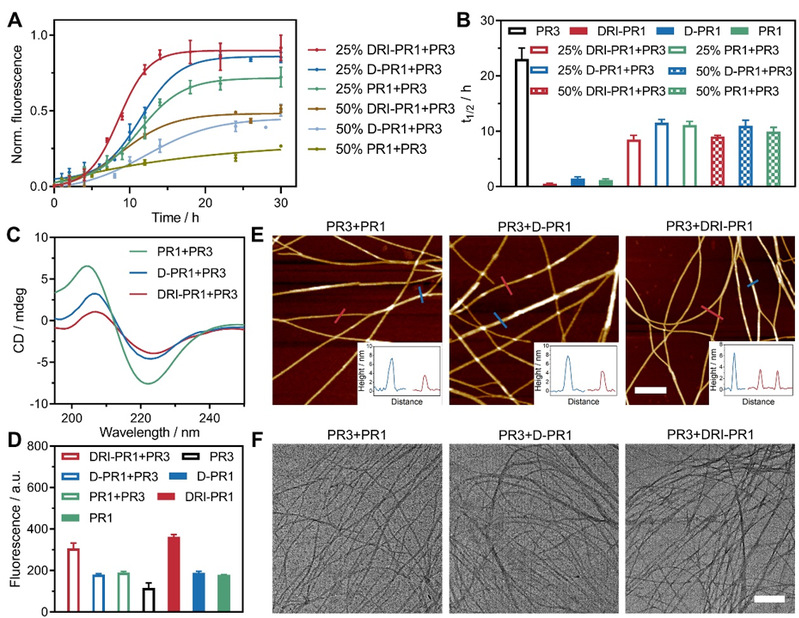
图2. PR3 与 RIPK1-生物仿生肽 PR1、D-PR1 和 DRI-PR1 共同组装的光谱和显微特征分析
此外,通过活细胞水平的机制研究,RIPK1-仿生肽可以诱导RIPK3的磷酸化增加,表明细胞坏死信号通路被激活,从而对RIPK3过表达的结直肠癌细胞系HT-29有特异性的细胞毒性,而且该过程没有造成炎症细胞因子的分泌明显增加。该工作凸显了多肽-蛋白质的聚集作为解决缺乏激动机制的“不可药用”问题的潜在优势,并为未来克服癌症抗药性提供了替代策略。

图3. RIPK1-仿生肽诱导细胞死亡的机理研究
论文得到了科技部重点研发计划、国家自然科学基金委及京津冀基础研究合作项目的支持。论文第一作者是南开大学博士研究生郭若宸,通讯作者为南开大学化学学院余志林研究员和李功玉研究员。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202314578




