来源:新威NEWARE
文章信息

第一作者:蒋卓良
通讯作者:李福军
通讯单位:南开大学
导读
基于氧还原(ORR)和氧析出(OER)反应的非质子型锂氧气电池具有高达3500 Wh kg-1的理论能量密度,受到研究人员的广泛关注。锂氧气电池在放电和充电过程均会产生O2-中间体,这会导致放电/充电动力学缓慢、过电位增大以及循环性能下降。高效正极催化剂可以通过调控活性位点与O2-之间的吸附作用来加快其还原/氧化的动力学,但是非均相ORR、OER反应固有的高能垒和高界面阻抗会导致其本征的动力学缓慢。高DN数的溶剂可以提高可溶O2-的浓度,从而将部分非均相反应转化为均相的O2-歧化反应,然而这个过程的动力学十分缓慢,并且伴随着高浓度O2-带来的副反应。提高O2-歧化反应的动力学,并且抑制相关副反应对锂氧气电池的进一步发展至关重要。
成果简介
近日,南开大学化学学院李福军课题组使用了三联吡啶钌阳离子(RB)作为锂氧气电池的溶液催化剂,改变了O2-在放电和充电过程中的歧化反应途径和动力学。RB可以捕获O2-二聚体并促进它们的分子内电荷转移,将歧化反应的能垒从7.70 kcal mol-1降低到0.70 kcal mol-1。这加快了放电反应和充电反应的动力学,降低了充放电过电位,同时减轻了O2-和1O2相关的副反应。研究成果发表在国际著名期刊Angew. Chem. Int. Ed.上,题为 “New Reaction Pathway of Superoxide Disproportionation Induced by a Soluble Catalyst in Li-O2 Batteries” (DOI: 10.1002/anie.202315314)。
关键创新
通过改变O2-歧化反应的途径来加快歧化速率,从而促进放电与充电过程的动力学。
核心内容解读
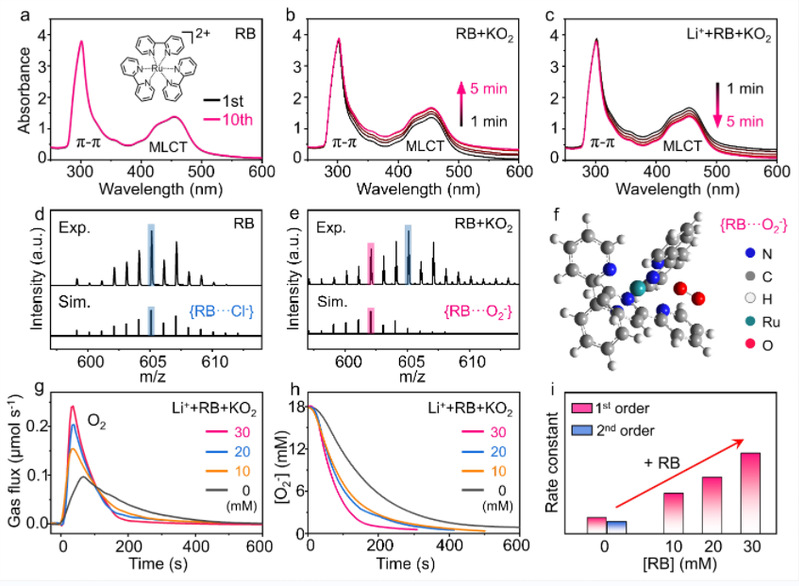
图1 RB加快O2-歧化反应的速率。
作者首先使用原位紫外可见光谱(in-situ UV-Vis)、超快电喷雾电离质谱(ESI-MS)和DFT理论计算证明了RB阳离子与O2-会结合产生一个相对稳定的{RB···O2-}中间体。然后作者使用了在线差分质谱(ODMS)研究不同RB浓度对O2-歧化速率的影响。在没有加入RB时,O2-的歧化反应是一个二级反应。这个二级反应在O2-浓度高于3.0 mM时,由于动力学较快,会表现出伪一级反应的行为。而加入RB之后,O2-的歧化反应完全转变成一级反应,并且其速率常数比没有RB的对照组增加了2~4倍。
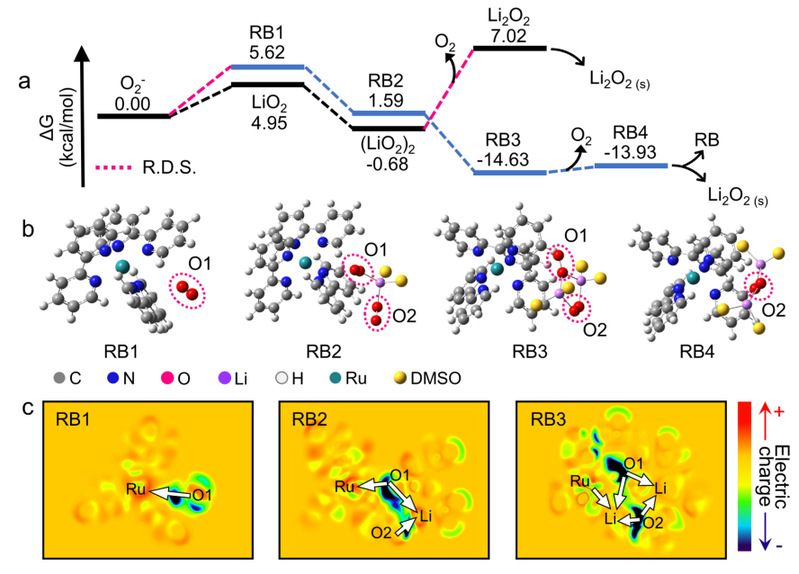
图2 RB促进O2-歧化的反应机理。
理论计算表明,RB诱导的歧化反应主要存在四个步骤:1)RB吸附第一个O2-,同时大量电荷从O2-转移至RB,形成RB1;2)RB1吸附一个溶剂化的LiO2,此时LiO2上的电荷进一步转移到RB上,形成RB2;3)RB2吸附第二个锂离子,大量电荷从RB转移回O2-二聚体,变成RB3;4)RB3快速解离成氧气和RB4,然后RB4中的过氧物种沉淀到电极上。由于RB促进了O2-二聚体的分子内电荷转移,所以反应能垒下降,歧化动力学加快。
歧化反应的反应级数与热力学决速步有关。对于RB诱导的歧化反应,决速步是O2-与RB结合产生RB1的过程(O2-+RB→RB1),根据O2-的化学计量数可以很容易判断,这个反应对于O2-是一级反应,因此RB介导的O2-歧化反应是一级反应。对于没有RB参与的歧化反应,O2-二聚体的解离需要跨越最高的能垒,所以决速步是(LiO2)2→Li2O2+O2。考虑到(LiO2)2的形成(2LiO2→(LiO2)2)是一个快速平衡的反应,他们整体对于O2-是二级反应。理论计算结果和OMES结果一致。
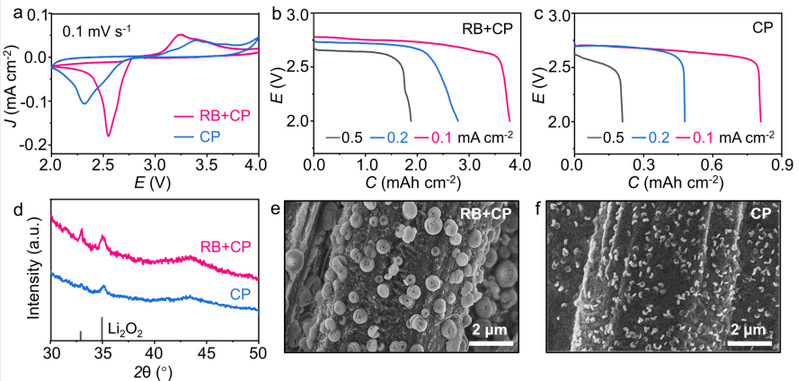
图3 RB促进放电过程。
为了验证歧化反应对放电过程的影响,作者使用了纯碳纸作为正极极片。纯碳纸具有非常小的比表面积,所以放电过程主要发生的是O2-歧化反应,而不是O2-还原反应。结果表明添加RB后,锂氧气电池的放电容量比没添加RB的对照组高4-10倍。相应地,添加RB后放电产物颗粒的尺寸也比没有添加RB的对照组大。

图4 RB对放电、充电过程的影响。
作者随后使用负载了Super P(SP)或者RuO2催化剂的极片组装锂氧气电池,研究电池在放电、充电过程发生的反应。电子顺磁共振(EPR)结果显示电解液中O2-的浓度在使用了RB催化剂后迅速下降;在使用RuO2催化剂后,1O2在充电过程的产生也得到抑制。这是由于RB可以加快O2-歧化速率,降低溶液中的O2-的浓度,减少O2-对DMSO溶液的攻击;RuO2可以降低充电电位,减少1O2的产生,从而抑制1O2和高电压带来的副反应。当RB和RuO2共同作用于锂氧气电池时,电解液在循环50圈之后没有副产物产生,并且DEMS结果证明电池具有非常好的可逆性。

图5锂氧气电池的电化学性能。
由于溶液催化剂RB与固体催化剂RuO2的协同作用,锂氧气电池的放电和充电动力学都得到提高。并且O2-和1O2相关的副反应都被抑制,电池的循环稳定性得到极大改善。在500 mA g-1电流密度下,锂氧气电池能在较低的过电位下稳定循环超过230圈。而对于不添加RB的锂氧气电池,循环50圈之后电池极化逐渐加大,循环105圈之后放电电位衰减到2.2 V 以下。
总结与展望
本工作证明RB阳离子是一种有效的溶液催化剂,能够加快O2-的歧化动力学,从而促进锂氧气电池的放电和充电过程。当RB与RuO2催化剂搭配使用时,充电电压显著降低,O2-和1O2引发的副反应得到抑制,因此锂氧气电池能在较低过电压下稳定循环超过230圈。这项工作突显了O2-歧化在锂氧气电池放电、充电反应中的关键作用,并提供了一种加快锂氧气电池反应动力学的新策略。
文章链接
Zhuoliang Jiang, Bo Wen, Yaohui Huang, Yihe Guo, Yuzhe Wang, Fujun Li*, New Reaction Pathway of Superoxide Disproportionation Induced by a Soluble Catalyst in Li-O2 Batteries, Angew. Chem. Int. Ed. 2023, DOI: 10.1002/anie.202315314.




