原创:汪清民教授课题组
导读
烯丙基酰胺结构广泛存在于天然产物,药物和农用化学品中。此外,烯丙基酰胺作为重要中间体可转化为一系列高附加值的有机骨架分子和材料。近日,南开大学汪清民教授课题组在这一领域取得重要突破,作者结合了光氧化还原、钴和Brønsted碱催化,以支链α-烯烃和简单酰亚胺为原料高效合成了烯丙基酰胺衍生物。机理研究表明,C(sp3)-N 键的形成由氮中心自由基中间体介导,该自由基中间体通过去质子化和单电子氧化产生。相关研究成果发表于Advanced Science,DOI:10.1002/advs.202411744。
成果
含氮官能团在有机合成和制药科学中至关重要,构建C-N键则是合成中最常用的手段。其中酰胺C-N键表现出特殊的化学和生物特性,尤其酰胺键是连接蛋白质的氨基酸构建单元。含酰胺键的烯丙基酰胺是天然产物、药物和农用化学品中常见的官能团(图1A),因此合成烯丙基酰胺有重要意义。通过烯烃的直接烯丙基酰胺化是形成酰胺C(sp3)-N 键的常见方法,这种方法不仅形成了酰胺的C(sp3)-N键构建,同时保留了烯烃的C=C键,使得酰胺化产物能够进行各种后续转化。
2016年,Cook课题组报道了通过钯催化实现线性烯丙基杂环酰胺的合成。2019年,Rovis、Glorius 和 Blakey等课题组分别报道了铑和铱贵金属催化合成了支链烯丙基酰胺。然而,这些反应受到严格的无水和厌氧条件的限制,贵金属催化剂的高成本和化学计量的氧化剂产生的化学废物阻碍了其合成应用的探索。尤其是多取代烯丙基酰胺的合成仍然极具挑战性。
近年来,模拟有效生物转化的仿生合成得到了广泛关注。特别是,将特定的金属离子(如Fe、Co、Ni和Mn)掺入有机框架中,作为仿生催化的活性位点,允许体系在温和、环保的条件下将反应物转化为产物。此外,仿生催化激发了合成小分子催化剂的设计,且已经开发了多种钴肟配合物来模拟天然存在的烷基钴胺酶的结构和催化活性。最初,这些复合物主要用作分解水的质子还原催化剂。近年来,光氧化还原/钴肟协同催化已被公认为一种经济、环境友好的仿生催化系统,并促进了有机合成的快速发展。
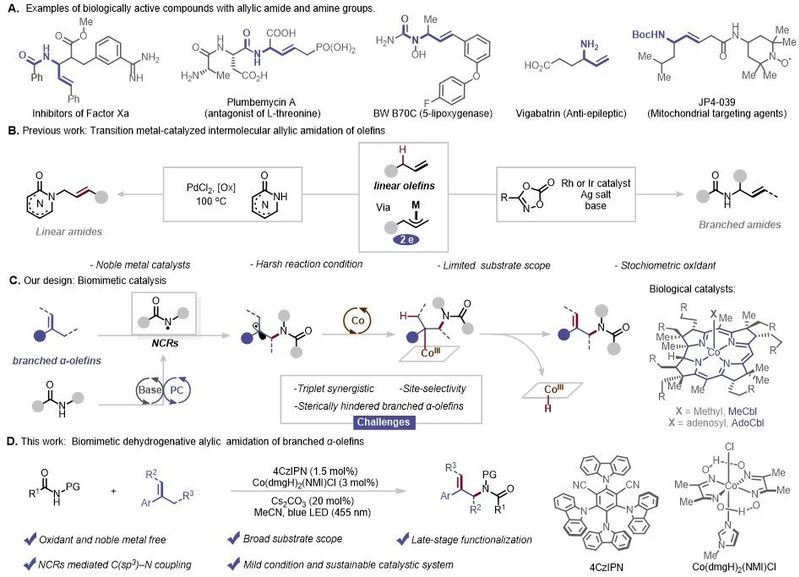
图1. 具有生物活性的烯丙基酰胺及其合成方法(来源:Advanced Science)
可见光诱导的转化不仅可以在温和的条件下将有机官能团生成多种自由基中间体,而且可以生成或裂解之前传统双电子化学难以实现的化学键。例如,氮中心自由基(NCR)的发展使得生成有价值的、以前具有挑战性的含氮化合物成为可能。此外,NCR的化学性质为构建C(sp3)-N键提供了多种可能性。然而,通过NCR介导的协同光氧化还原/钴肟催化的脱氢烯丙基胺化尚未报道。在本篇文章中,作者设想通过Brønsted碱/光氧化还原催化产生的NCR介导的C(sp3)-N 键形成。随后,钴肟催化选择性消除β-H形成不饱和键并提供烯丙基酰胺产物(图1C)。实现该设想需要克服几个挑战:(1)氮中心自由基可能会添加到烯烃中形成空间位阻的自由基中间体,这些自由基中间体需要被匹配的钴种类捕获;(2)钴中间体将选择性地进行β-H消除反应,而不是进行氢化反应生成烷基酰胺;(3)光催化剂、钴和Brønsted碱的组合将是相互依赖和再生的,这需要催化同步。综上,作者开发了一种通用的温和方法,用于支链 α-烯烃的仿生脱氢分子间形式烯丙基酰胺化,用于通过光氧化还原、钴和Brønsted碱催化的组合构建取代烯丙基酰胺(图1D)。
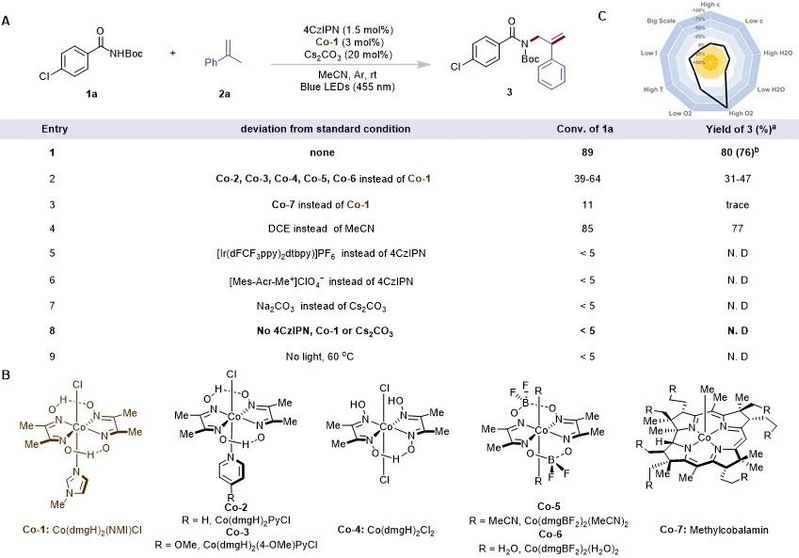
图2. 反应的条件筛选(来源:Advanced Science)
在条件筛选中,作者通过使用N-Boc p-Cl-苯甲酰胺(1a)作为氮中心自由基源和α-甲基苯乙烯(2a)作为脱氢形式烯丙基酰胺化的反应模板开始研究(图2A)。经过广泛的优化实验,作者发现在室温(30°C)下,在氩气下用蓝色 LED(455 nm)照射两种底物的乙腈溶液和1,2,3,5-四(咔唑-9-基)-4,6-二氰基苯(4CzIPN,1.5 mol%)、钴肟(Co-1, 3 mol%,图2B)和Cs2CO3(20 mol%)和蓝色LED(455 nm)在氩气下照射48小时,得到目标烯丙基酰胺衍生物3,分离产率为76%(图 2A,条目1)。当其他钴肟代替Co-1参与反应时,观察到产率明显下降(条目2)。作者推测Co-1的轴向N-Me-咪唑配体导致在该反应中比具有吡啶或卤素配体的络合物更稳定的复合物。当使用甲基钴胺素(Co-7)时,仅产生微量的目标产物,并且1a的转化率非常低(条目3)。溶剂效应评估表明,1,2-二氯乙烷是乙腈的合适替代品(条目4)。其他光催化剂和Brønsted碱没有目标产物生成(条目5-7);也就是说,4CzIPN和Cs2CO3分别作为光催化剂和Brønsted碱是不可替代的。对照实验表明,光催化剂、钴肟、碱和光对反应的成功至关重要(条目8和9)。基于最优条件的反应灵敏度评估(图2C)表明,即使改变一些重要的反应参数(如水量、反应规模、温度和浓度),反应也能保持良好的产率。此外,当反应体系未脱气时,产物3的产量略有下降。然而,当反应在空气中进行时,产率大幅下降,表明氧气对反应具有较大负面影响。
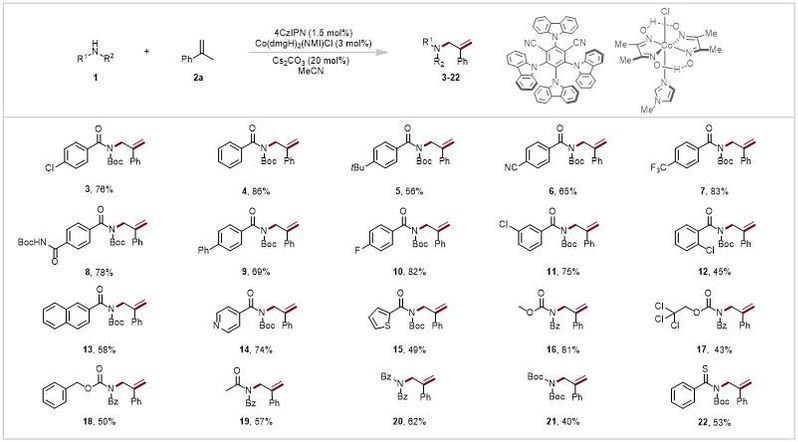
图3. 酰亚胺的底物拓展(来源:Advanced Science)
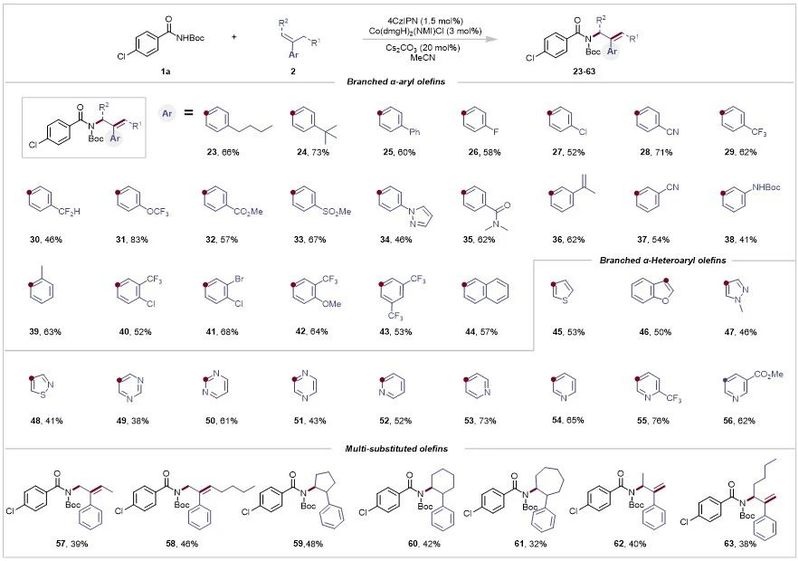
图4. 烯烃的底物拓展(来源:Advanced Science)
在最佳条件下,作者研究了各种N-Boc酰胺与2a反应的适用性(图3)。温和的反应条件与未取代的苯环(4)和带有各种官能团叔丁基(5)、氰基(6)、三氟甲基(7)、N-Boc酰胺基(8)和苯基(9)的苯环相容;收率从42%到86%不等。此外,带有对位氟和多种氯原子的N-Boc苯甲酰胺成功地转化为目标产物(3,10–12),尽管由于空间位阻的影响,具有邻位氯原子的底物的产率相对较低。除了含有萘基而不是苯基(13,58%)的产品外,还可以制备带有吡啶基(14,74%)或噻苯(15,49%)基团的产品。作者还探讨了酰亚胺型偶联伙伴的反应。此外,CO2Me保护、2,2,2-三氯乙氧基羰基保护、苄氧羰基保护和乙酰保护酰胺与支链α-烯烃2a发生了所需的烯丙基酰胺化反应,分别提供了产物16-19。同时,N-苯甲酰基苯甲酰胺 [(Bz)2NH]和N-Boc-叔丁基氨基甲酸酯[(Boc)2NH]以62%和40%的产率提供所需的烯丙基胺20和21。这些产品可以转化为各种带有支链α-烯烃基团的烯丙基胺衍生物。作者发现N-Boc 硫代苯甲酰胺也被耐受,产率为53%,可用于构建高价值的含硫杂环。
接下来,作者将重点转移到支链α-烯烃的反应范围(图4)。支链α-芳基烯烃与芳基环上的间位或对位取代基反应,得到相应产物的中等至良好产率(23–38)。特别是,具有含氟官能团的底物可以成功耐受,这些基团可以通过增强亲脂性、生物利用度和代谢稳定性来改善母体分子的治疗特性(26,29–31)。具有邻位取代芳基环的底物也具有耐受性,并以61%的产率提供产物39。二取代芳香族底物也是可接受的反应伙伴,以52-68%的产率获得40-43的产物。带有萘环的底物也经历了所需的反应(44)。
由于杂芳基是药物化合物中普遍存在的重要官能团,因此作者研究了与杂芳基支链 α-烯烃的反应。带有噻吩(45)、苯并呋喃(46)、N-甲基吡唑(47)、噻唑(48)、嘧啶(49,50) 或吡嗪(31)环的底物提供了相应的烯丙基酰胺,产率中等至良好。值得注意的是,带有吡啶环的支链α-烯烃以52-76%的收率提供了多种产品(52-56)。此外,空间位阻多取代烯烃适用于这种转化,尽管产率较低,但仍能得到57和58。此外,基于环戊烯、环己烯和环庚烯的底物成功功能化,分别形成所需的产物59-61。作者证明了也可以获得支链烯丙基酰胺(62, 63),这表明该方法的广泛底物范围。温和的条件使该反应适用于各种天然产物和药物分子的修饰(图 5A)。例如,从氟比洛芬(64)、对羟基苯甲酸丁酯(65)、托那利(66)、天青素(67)、雌酮(68)、酮洛芬(69)、吉非罗齐(70)、L-薄荷醇(71)、芬酚(72和73)、D-脯氨酸(74)、羟脯氨酸(75)和去甲托品(76)衍生的支链α-烯烃成功通过反应,证明其具有很强的官能团相容性。丙磺舒的N-Boc酰胺衍生物与适当的偶联伴侣结合时,产物77和78的产率分别为72%和58%,这表明该反应在药物化学中的潜力。
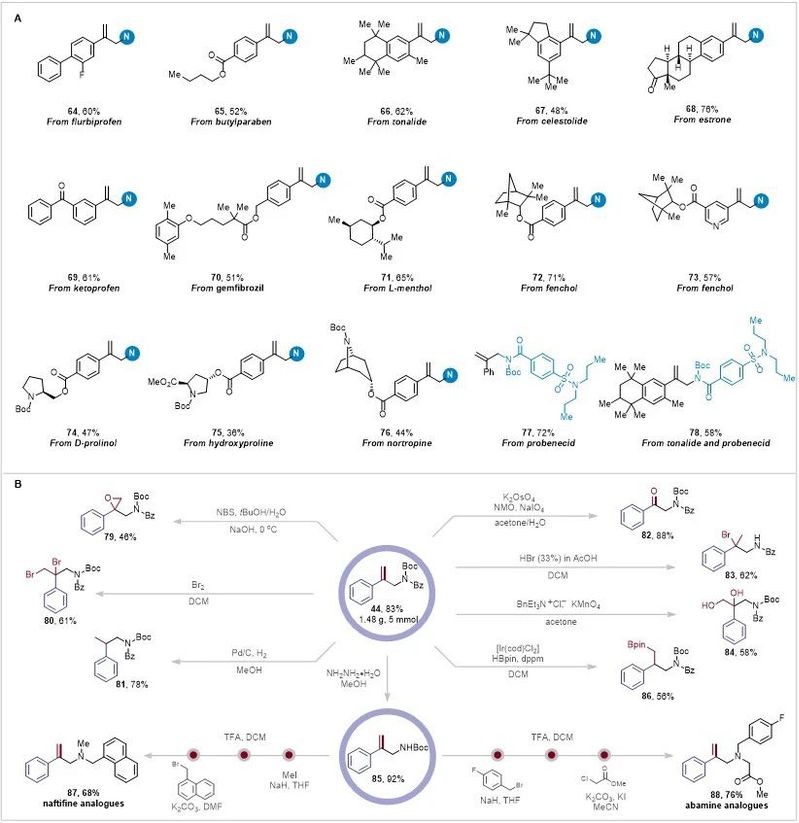
图5. 反应的应用(来源:Advanced Science)
为了进一步证明反应在有机合成中应用,作者在标准条件下合成了克级的烯丙基酰胺衍生物,然后将其转化为许多有用的分子(图5B)。例如,烯丙基酰胺44中的C=C键环化得到β-酰胺环氧乙烷79,用Br2处理烯丙基酰胺44得到 β,γ-二溴取代的酰胺80,烯丙基酰胺44在钯炭和氢气氛围下氢化得到化合物81。此外,通过断裂烯丙基酰胺44 C=C键可以获得β-羰基酰胺82。值得注意的是,合成β溴化酰胺83是具有挑战性的,反应形成季碳中心可以作为一种多功能有机结构单元。此外,通过烯丙基酰胺44的二羟基化和硼氢化反应分别得到化合物84和反马氏加成产物86。
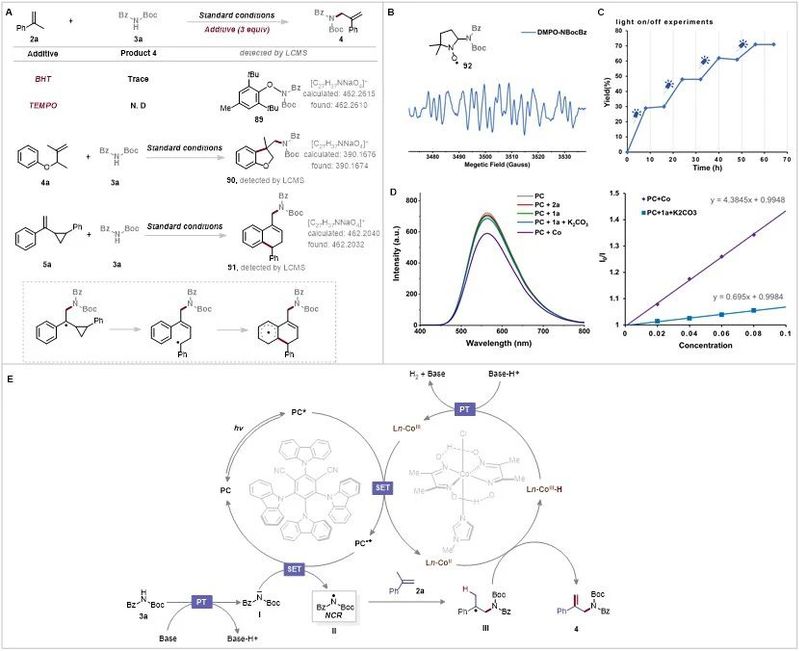
图6. 机理研究(来源:Advanced Science)
为了阐明反应机理并证明NCR是在脱氢烯丙基酰胺化过程中产生的,作者在标准反应条件下使用BHT和TEMPO(2,2,6,6-四甲基哌啶氧化物) 作为自由基清除剂进行了自由基捕获实验。作者发现支链α-烯烃2a和N-Boc苯甲酰胺3a的反应被自由基清除剂抑制,BHT与N-Boc苯甲酰胺自由基偶联产生加合物89,通过ESI-HRMS检测。作者还用4a和3a进行了自由基钟实验,结果显示4a在标准条件下发生了所需的反应,得到环化产物90(图 6A)。
当(1-(2-苯基环丙基)乙烯基)苯(5A)与3A反应时,通过打开环丙烷环生成产物91(图6A);这些结果表明,反应通过环丙基甲基自由基中间体进行,该中间体与栓系芳烃发生分子内自由基环化。此外,为了更深入地了解反应的 NCR,作者在标准条件下使用5,5-二甲基吡咯啉N-氧化物(DMPO)作为自由基自旋捕获剂进行了电子顺磁共振研究。在用蓝色LED照射光催化系统10分钟后,作者观察到明显的氮自由基电子顺磁共振信号(图6B)。接下来,光开/关实验验证了反应在没有光的情况下完全停止(图6C),这表明任何链传播过程都是瞬态的,连续照射是必不可少的。为了深入了解光催化循环,作者进行了一系列 Stern-Volmer淬灭实验(图6D),结果表明光催化剂的激发态没有被2a和3a淬灭。此外,3a和Cs2CO3的等摩尔混合物表现出较小的光催化剂淬灭速率。此外,钴肟对激发态光催化剂的猝灭作用比任何其他反应组分都要明显得多,这表明转变是通过氧化猝灭机制进行的。
作者提出了图6E所示的反应机理。首先,由PC的可见光照射产生的PC*激发态被CoIII物种淬灭,生成PC•+和活性CoII物质。在碱存在下,N-Boc苯甲酰胺3a去质子化生成亚胺阴离I。亚胺阴离子I被PC•+被氧化,得到关键的NCR II并再生光催化剂。随后,氮中心自由基II加成到支链α-烯烃2a中,形成C(sp3)-N键并提供中间体III,最后通过选择性β-H消除过程得到产物4和CoIII-H物种。CoIII-H物种的淬灭会再生CoIII物质并释放出氢气以关闭催化循环。
总结
作者开发了一种温和、高效的方法,以简单酰亚胺和支链α-烯烃为原料,实现了仿生脱氢的分子间烯丙基酰胺化反应,得到了一系列取代的烯丙基酰胺。反应通过双Brønsted碱/光氧化还原催化剂协同作用产生用于形成C(sp3)-N键的氮中心自由基,随后钴-/光氧化还原协同催化的实现反应的脱氢交叉偶联。该方法具有广泛的底物范围、良好的官能团兼容性,可用于结构复杂的分子的转化。此外,烯丙基酰胺可以作为重要中间体进一步转化为多种有用的有机化合物。最后,作者相信这种仿生的多重催化反应为烯丙基化反应注入新的活力。
致谢:
本篇工作通讯作者为汪清民教授。南开大学博士研究生付肖扬为该论文的第一作者。特别感谢刘玉秀和宋红健老师在实验中的指导和帮助。上述研究工作得到了国家自然科学基金(21732002、22077071)和南开大学有机新物质创造前沿科学中心(63181206)的资助。特别感谢天津凯米斯科技有限公司提供优秀奖学金。
汪清民课题组简介
南开大学汪清民课题组隶属于南开大学元素有机化学国家重点实验室、有机新物质创造前沿科学中心和化学学院。目前课题组拥有老师和研究生20多人。研究方向为生态农药和药物及功能助剂创制和环境友好的绿色合成反应。承担科技部、农业部、国家自然科学基金委、教育部、天津市等各种科研项目四十多项。先后在Sci. Adv.、Nat. Commun.、Angew. Chem. Int. Ed.、Adv. Sci.、ACS Cent. Sci.、Chem. Eng. J.、ACS Catal.、Chem. Sci.、Green Chem.、ChemSusChem.、ACS Sustainable Chem. Eng.、Arthritis & Rheumatism、J. Agric. Food Chem.、Pest Manag. Sci.、J. Med. Chem等杂志上发表论文300余篇;授权了100多项中国和美国及欧洲等发明专利。出版著作5部(章);发明了仿生农药拟除虫菊酯系列产品和重多农药品种及高端精细化学品的清洁生产新方法,已成功应用于工业化大生产,产生了巨大的经济效益;创制了多个超高效的植物病毒病防治药剂和绿色杀虫杀螨剂候选品种以及国家Ⅰ类新药,处于产业化开发的不同阶段。培养毕业了100多名访问学者、博士后、博士生、硕士生。




