来源:Biotic Nano
一氧化碳(CO)作为一种内源性气体信号分子,在调节生理过程(如抗炎、抗氧化、血管舒张)方面具有重要作用,近年来也被发现可以用于 抗肿瘤治疗。CO 通过 抑制线粒体氧化磷酸化、阻断 ATP 生成,诱导肿瘤细胞凋亡,同时能够增强 肿瘤免疫微环境(TME) 的调控能力。然而,CO 作为气体,难以靶向递送,并且传统 CO 供体(CORMs)依赖肿瘤微环境(如 ROS、GSH、低 pH)触发释放,释放速率不可控,难以达到理想的治疗剂量。此外,部分 CORMs 在代谢过程中具有潜在的细胞毒性,这进一步限制了 CO 在肿瘤治疗中的应用。光触发 CO 释放(photoCORMs) 由于其 非侵入性、高时空精度、可调节剂量 等优势,成为 CO 供体研究的前沿方向。然而,当前 photoCORMs 仍然存在 波长局限(UV/蓝光穿透力低)、释放效率低、光敏剂毒性残留 等挑战。

图1. 期刊论文
基于此,来自南开大学刘书琳/黄灵团队提出了一种 红光(655 nm)驱动的双通道 CO 释放系统,以优化 CO 在肿瘤治疗中的应用,提高其光响应释放效率,并增强抗肿瘤活性。该研究于近日以Dual Pathways of Photorelease Carbon Monoxide via Photosensitization for Tumor Treatment为题在线发表于Journal of the American Chemical Society期刊。
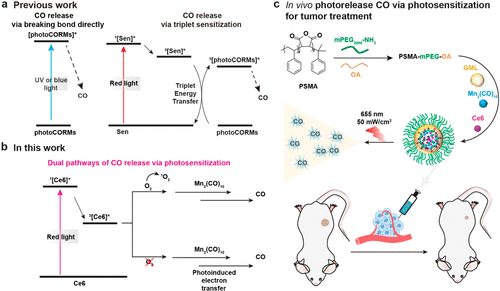
图2. 通过光敏作用释放 CO 的双途径用于肿瘤治疗的图示
研究方法
UV-Vis 吸收光谱检测 CO 释放:监测 Mn₂(CO)₁₀ 在不同光照条件下的吸收峰变化,确定光触发 CO 释放的规律。
复合纳米颗粒(Ce6-MCO NPs)制备与表征:聚合物自组装 包裹 Ce6 和 Mn₂(CO)₁₀,形成水分散性纳米颗粒;采用 透射电子显微镜(TEM)、动态光散射(DLS) 分析纳米颗粒的形貌、尺寸及稳定性。
细胞毒性检测(CCK-8):评估 CO 释放后对结直肠癌细胞(CT26)的生长抑制作用;
细胞凋亡检测:利用 Calcein-AM/PI 双染 观察 CO 诱导的细胞死亡情况。
CT26 皮下移植瘤小鼠实验:评估 Ce6-MCO NPs+光照对肿瘤体积的影响;
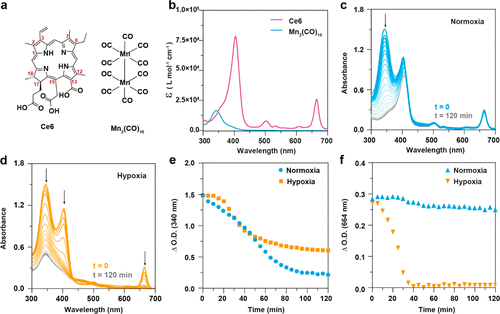
图3. Ce6和Mn2(CO)10分别在空气饱和(常氧)和氩气饱和(缺氧)溶剂下的光化学反应
关键发现
氧饱和环境(常氧):Ce6 产生 单线态氧(¹O₂),氧化 Mn₂(CO)₁₀,促进 CO 释放;
缺氧环境(肿瘤微环境):Ce6 通过 光诱导电子转移(PET) 触发 Mn₂(CO)₁₀ 自由基裂解,提高 CO 释放速率;GC-MS 结果表明,该方法在缺氧和常氧条件下均可高效释放 CO,优于传统光响应 CO 供体。
复合纳米颗粒:(Ce6-MCO NPs)实现稳定 CO 释放通过 两亲性聚合物包裹 Mn₂(CO)₁₀ 和 Ce6,提高其 水溶性、稳定性和生物相容性;红光(655 nm, 50 mW/cm²)照射触发 Ce6-MCO NPs 释放 CO,避免了短波光(UV/蓝光)的生物毒性。
体外抗肿瘤效果:Ce6-MCO NPs 在红光照射下显著抑制 CT26 细胞生长,CO 诱导细胞凋亡;活细胞成像证实 CO 通过破坏线粒体功能和 ATP 生成导致肿瘤细胞死亡。
体内抗肿瘤效果:CT26 皮下肿瘤小鼠实验表明,Ce6-MCO NPs+红光照射能显著抑制肿瘤生长(肿瘤抑制率接近 100%);H&E 染色结果证实 CO 释放导致肿瘤组织大面积坏死;小鼠体重无明显变化,血液学分析正常,表明该策略具有良好的生物安全性。
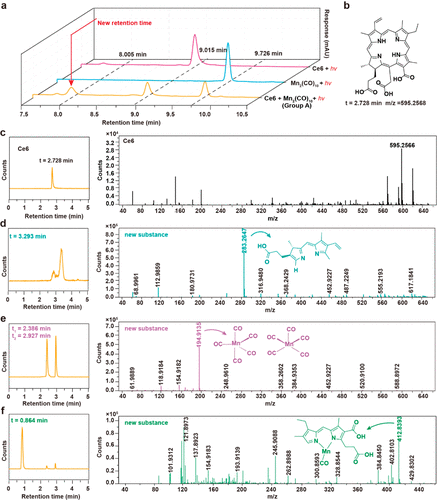
图4. 用HPLC和LC-QTOF-MS表征了在饱和氩气DMA中,在655 nm光(50 mW/cm2)照射下光化学反应120 min后Ce6及其混合物(Ce6和Mn2(CO)10)
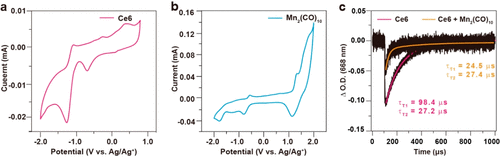
图5, Ce6和Mn2(CO)1的循环伏安曲线和纳秒瞬态吸收光谱
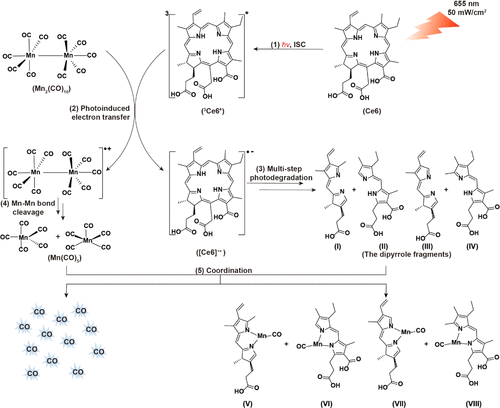
图6. 功率密度为50 mW/cm2的655 nm光照射下光敏剂自降解光敏释放CO的可能机理
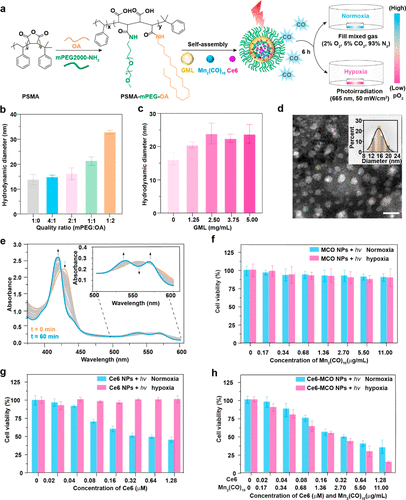
图7. Ce6 NPs、MCO NPs和Ce6-MCO NPs的设计、制备和体外表征。

图8. Ce6-MCO NPs体内释放CO的抗肿瘤作用。
总结
提出了一种全新的双通道 CO 释放机制,结合 光敏化单线态氧(¹O₂)氧化 和 光诱导电子转移(PET),提高 CO 释放效率;开发了一种水溶性 Ce6-MCO 纳米颗粒,在 肿瘤缺氧微环境 下实现更高效的 CO 释放,增强抗肿瘤疗效;体内外实验验证了该策略的有效性,展现出 卓越的肿瘤抑制效果和较高的安全性,为 CO 介导的肿瘤治疗提供了新的策略。
参考文献:
https://pubs.acs.org/doi/10.1021/jacs.4c18400articleRef=control




