原创:庞代文教授课题组
导语
病毒侵染是一个高度复杂、多步骤的动态过程,如同一场精心策划的“特工行动”,涉及进入细胞、胞内运输以及膜融合释放基因组等多个紧密衔接的关键环节。然而,传统研究技术大多只能提供静态、平均化的信息,好比观看一张张孤立的照片,难以捕捉其快速连贯的动态全貌。这一研究瓶颈,随着单病毒示踪技术的出现迎来了革命性突破。该技术基于荧光标记与活细胞成像,犹如为病毒配备了“微型GPS”,使得科学家能够在单颗病毒粒子水平上,实时追踪病毒从进入细胞到基因组释放的完整行为轨迹,从而揭示病毒与宿主细胞相互作用的动态细节。近日,南开大学庞代文教授团队在Acc. Chem. Res.上发表了题为“Revealing Mechanisms in the Early Stages of Virus Infection by Single-Virus Tracking” 的论文(DOI:10.1021/acs.accounts.5c00491),系统总结了其团队单病毒示踪技术在解析病毒感染早期机制中的关键进展。论文重点聚焦于三大核心生物学过程:病毒入侵的分子机制、病毒粒子的胞内运输途径,以及膜融合与基因组释放的动态过程,首次系统性地构建了病毒感染早期的动态全景图。此外,论文还前瞻了该技术的未来发展,如开发更小更亮的荧光探针、推动活体三维成像应用等,为病毒学及相关领域研究提供了强大的新工具及新视角。
前沿科研成果
1. 单病毒示踪技术
单病毒示踪技术流程主要包含三个核心步骤:荧光标记、数据采集与数据分析。具体而言,在利用单病毒示踪技术研究病毒感染时,首先需对病毒进行荧光标记;随后通过光学成像系统检测单个病毒粒子的荧光信号,并记录其行为轨迹;最终对采集的数据进行处理与分析,以揭示病毒的运动模式及其感染机制。
高效、精准的荧光标记策略是单病毒示踪技术得以实现的关键。其中,量子点凭借其亮度高、光稳定性较好等突出特性,成为动态追踪研究中理想的荧光标记物。庞代文教授团队长期致力于开发量子点病毒标记体系。为满足不同层面的实验需求,近年来该团队针对病毒的不同结构组分,发展了一系列具有针对性的量子点标记方法,以实现对病毒生命周期的精细解析。例如:(1)病毒包膜标记策略:通过将生物素化磷脂嵌入病毒包膜,再与链霉亲和素修饰的量子点结合,实现了高达98%的标记效率,为研究包膜病毒进胞及胞内运输等早期过程提供了有力工具。(2)病毒衣壳标记策略:利用AP-Tag技术在病毒扩增时对衣壳蛋白进行生物素化,实现位点特异性标记,为研究病毒脱壳及衣壳运输机制提供了关键技术。(3)病毒RNA标记策略:利用CRISPR/Cas13系统,在病毒组装过程中对基因组进行标记,使得实时观测病毒基因组的动态行为成为可能(图1)。
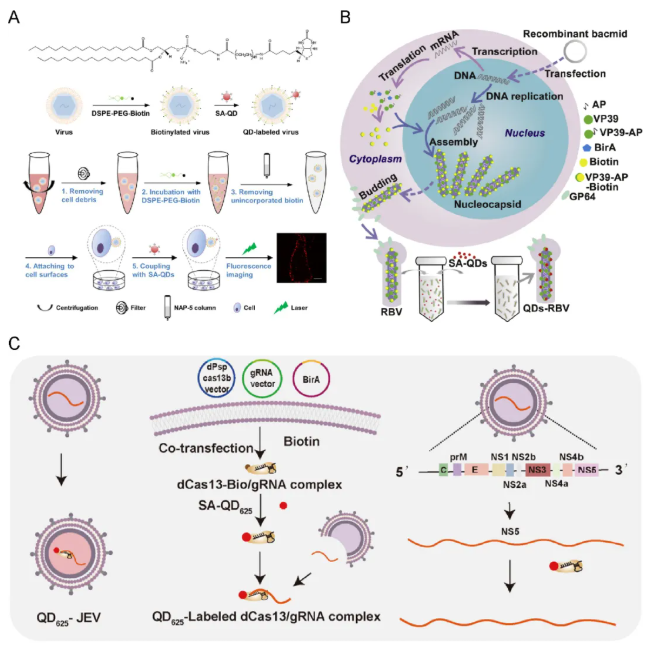
图1. 量子点标记病毒不同组分的典型策略(图片来源:Acc. Chem. Res.)
2. 单病毒示踪技术全面解析病毒侵染早期阶段
病毒进胞机制的动态解析:病毒内吞途径及感染机制的研究一直是病毒学领域的核心科学问题之一。庞代文教授团队创新性地采用单病毒示踪技术结合多色荧光成像系统,系统解析了甲型流感病毒(Influenza A virus, IAV)的内吞机制。研究发现,IAV通过与宿主细胞膜表面含有唾液酸残基的受体结合后,主要通过两种不同的内吞途径完成内化:网格蛋白介导的内吞途径(clathrin-mediated endocytosis, CME)(约占80%)和非网格蛋白介导的内吞途径(clathrin-independent endocytosis, CIE)(约占20%)。在CME途径中,研究团队首次揭示了完整的动态内化过程:(1)初始包被小窝形成阶段:病毒结合细胞表面的受体后招募网格蛋白形成初生包被小窝,同时募集FCHo2蛋白协助膜曲率改变;(2)小窝成熟阶段:该结构持续募集网格蛋白和epsin1,使膜内陷逐步加深,形成从平缓到深度内陷的包被小窝;(3)颈部稳定与收缩阶段:鞘磷脂-胆固醇微结构域与FBP17协同作用稳定内陷颈部结构,同时肌动蛋白丝在小窝颈部位置组装,促进深度内陷的网格蛋白包被小窝形成收缩的颈部结构;(4)囊泡形成阶段:endophilinA2被募集后进一步紧缩颈部结构,最终通过发动蛋白缩缢形成网格蛋白包被囊泡。此外,数据显示约20%的IAV经由一种特殊的非网格蛋白依赖型,但依赖发动蛋白与肌动蛋白的途径(即CIE途径)完成内化。特别值得关注的是,研究发现大部分病毒不会进入细胞,其中包含相当比例的病毒粒子虽然能够成功结合于细胞表面并启动内吞相关蛋白(如网格蛋白和发动蛋白)的募集,但最终未能完成内化过程。这些“无效募集”现象为理解病毒-宿主相互作用的复杂性提供了新的视角(图2)。
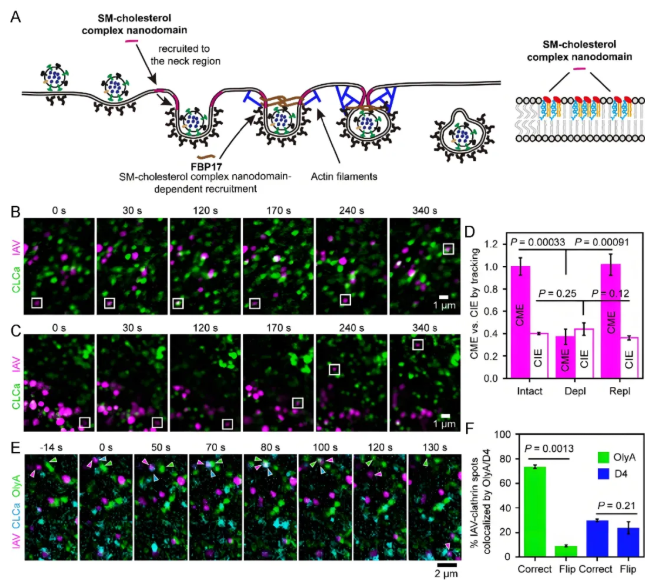
图2. SM-胆固醇复合物纳米域被招募至网格蛋白包被结构以介导IAV内化(图片来源:Acc. Chem. Res.)
针对通过质膜融合方式入侵的病毒,研究团队成功开发了一种基于量子点标记与杂交链式反应(HCR)的定量单病毒示踪技术。该技术为动态、定量研究病毒的膜融合过程提供了全新平台。具体来说,采用生物素化磷脂(DSPE-PEG2000-biotin)嵌入病毒包膜并与链霉亲和素修饰的量子点(SA-QDs)特异性结合,实现了病毒包膜的高效标记。同时,创新性地应用Cy5标记的HCR链自组装系统,实现了病毒基因组的特异性标记和荧光信号放大,有效克服了传统荧光染料在亮度、光稳定性和信噪比等方面的固有局限。通过单病毒示踪技术结合超分辨率显微镜成像,研究发现SARS-CoV-2可能通过诱导过饱和胆固醇在ACE2和TMPRSS-2受体周围形成更大尺度的簇状聚集,从而促进病毒包膜与质膜的融合及基因组释放。
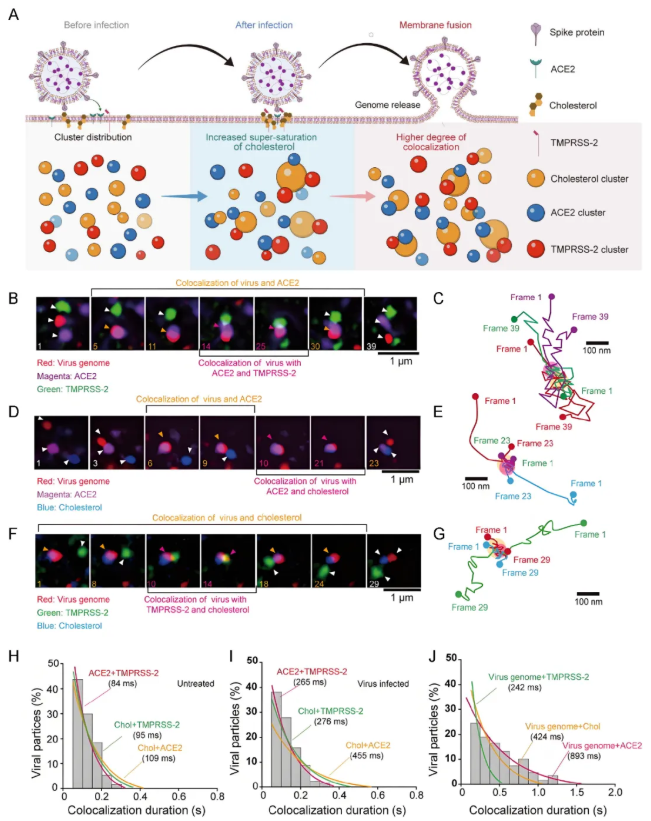
图3. 病毒膜融合进胞过程的多色示踪(图片来源:Acc. Chem. Res.)
病毒胞内运输路径的动态解析:团队以IAV为模型,通过整合单病毒示踪技术与多色活细胞动态成像系统,实现了对单个病毒进胞后到达微管全过程的原位实时解析。研究发现,病毒可通过三条独立且相互协调的途径完成这一过程:(1)Myosin VI驱动途径(AF途径):病毒在Myosin VI驱动下沿肌动蛋白丝移动至微管。值得注意的是,该途径存在独特的驱动切换机制:动力蛋白在肌动蛋白丝上以搭便车方式伴随转运,当病毒抵达肌动蛋白丝-微管交界处时,dynein接管并驱动病毒沿微管继续向核周区移动,而Myosin VI仍保持与囊泡的结合共转运。这一发现首次揭示了病毒在两种细胞骨架系统间的精密转接机制。(2)肌动蛋白尾推动途径(AT途径):病毒在Arp2/3复合体介导的肌动蛋白聚合形成的肌动蛋白尾的推动下到达微管。该途径仅在病毒高载量感染时显著激活,提示细胞可能通过特定信号通路调控不同转运途径的切换。(3)非肌动蛋白依赖途径(NA途径):病毒直接到达微管,未经历与肌动蛋白相关的运动。这种途径占比最高(~70%)且最快到达微管(图4)。
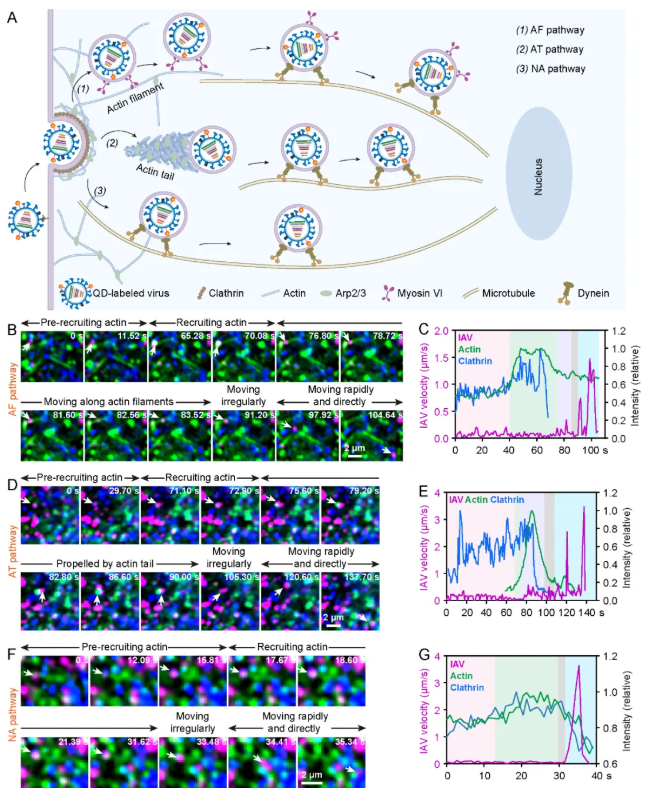
图4. IAV进胞后到达微管的三条途径(图片来源:Acc. Chem. Res.)
为系统研究病毒沿微管的运输行为,研究团队采用单病毒示踪技术对荧光标记的单个病毒粒子沿微管向细胞核转运的过程进行了可视化研究,并结合群体行为的统计分析,揭示了病毒运输的精细动态特征。研究发现,在IAV病毒内吞后、尚未与微管接触时,包裹病毒的囊泡已与dynein及其激活蛋白dynactin结合。一旦病毒与微管相遇,无论其初始结合位置是微管正端还是其他区域, dynactin 辅助的dynein都会启动病毒向细胞核方向的定向运动。值得注意的是,病毒在微管上的长程运输行为高度动态化,表现出快速定向(>0.5 μm/s)、慢速定向(< 0.5 μm/s)和非定向等复杂运动模式。此外,微管网络的拓扑结构显著影响病毒的运输行为。微管交叉分布会干扰病毒的运输效率,有时会导致运动速度降低、方向改变甚至长时间停滞。高时空分辨率动态追踪揭示了病毒在微管上的六种典型运动模式:(1)沿单根微管持续单向运动;(2)在微管交叉点附近减速后,沿原微管反向运动;(3)在微管交叉点附近减速后,继续沿原微管同向运动;(4)在微管交叉点附近减速后,转向沿另一微管运动;(5)在微管网格结构中受限运动;(6)在微管交叉点附近的小范围内往复运动(图5)。
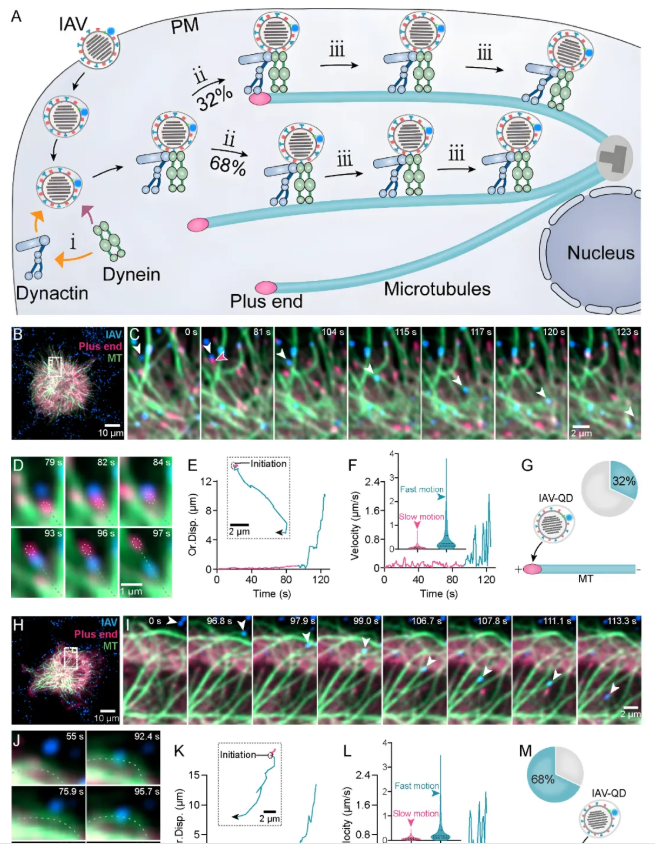
图5. IAV沿微管逆行运输:微管正端并非唯一起始点(图片来源:Acc. Chem. Res.)
膜融合与基因组释放的实时可视化:研究团队以RNA包膜病毒日本脑炎病毒(Japanese encephalitis virus, JEV)为模型,整合了单病毒示踪技术与双标记原位pH定量方法:通过量子点标记病毒包膜,配合pH敏感染料标记病毒RNA,成功建立了可在单病毒水平实时可视化并定量分析基因组释放过程的技术平台。研究发现:(1)JEV的细胞内运输严格依赖肌动蛋白和微管细胞骨架系统;(2)病毒膜融合事件主要发生在早期内体向晚期内体过渡的成熟阶段(图6)。
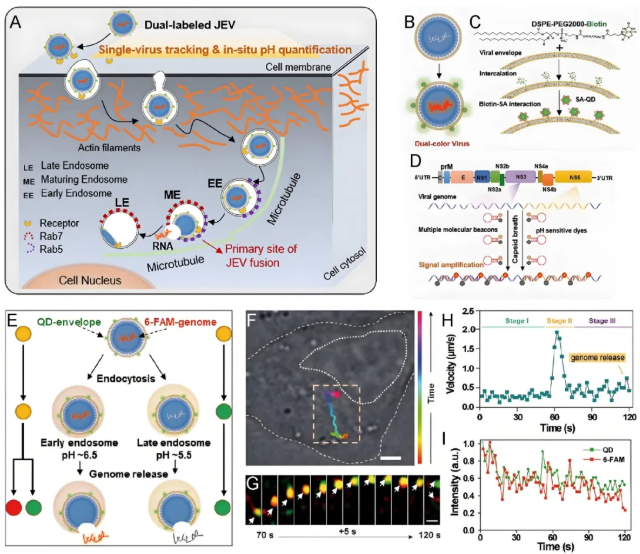
图6. pH敏感双标记JEV在活细胞中的基因组释放行为(图片来源:Acc. Chem. Res.)
综上所述,单病毒示踪技术凭借其原位、实时的动态观测能力,已成为阐明病毒-宿主相互作用机制的重要研究工具。庞代文教授团队通过创立并应用该技术,在病毒内化,胞内运输以及膜融合释放基因组等早期感染过程研究中取得了系统性发现(图7)。然而,当前该技术仍面临荧光标记效率与特异性不足、光毒性与光漂白效应限制长期观测、以及在体三维成像困难等挑战。展望未来,技术发展应聚焦于三个关键方向:一是开发更小、更亮、生物相容性更好的新型标记物及相应探针(如超小型量子点标记物);二是创建低光毒性超分辨率成像技术;三是推动技术从体外细胞模型向在体三维组织成像拓展。随着近红外荧光探针和活体显微成像技术的不断进步,特别是具有高组织穿透性和低背景干扰的超小型近红外量子点的出现,为在真实生理环境下解析病毒感染动态行为提供了可能。作者相信,持续优化的动态成像技术将不仅推动病毒学研究范式的变革,更将在生命科学领域发挥日益重要的作用。
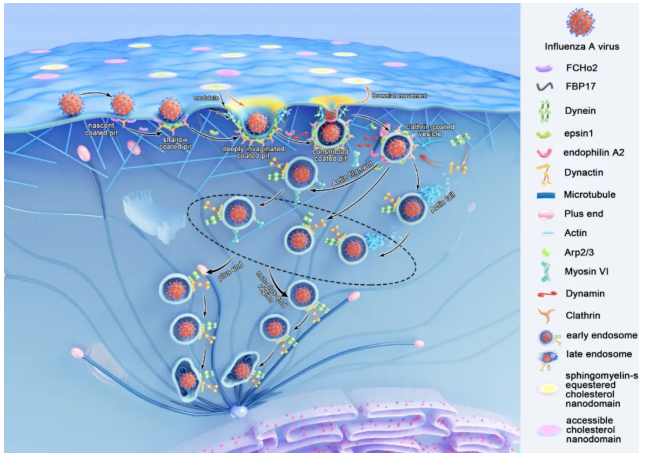
图7. IAV通过CME途径侵染早期的机制(图片来源:Acc. Chem. Res.)




