来源:化学缘
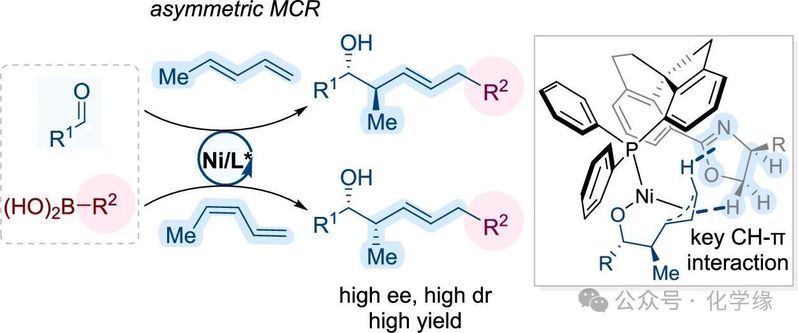
南开大学肖力军课题组通过发展具备双重CH-π作用的手性螺环配体镍催化剂,实现了1,3-二烯、醛以及硼酸的不对称多组分偶联反应,为聚酮结构的高立体选择性合成提供了新方法。
Abstract
Polyketides are renowned for their structural complexity and potent biological activity, yet efficient and stereocontrolled synthesis of their densely functionalized motifs remains a formidable challenge. Here, we report a nickel-catalyzed, stereoselective multicomponent coupling that assembles polyketide-like architectures from an aldehyde, a diene, and an organoboronic acid in a single operation. This transformation forges two carbon–carbon bonds, establishes defined olefin geometry, and generates two contiguous sp3stereocenters with high diastereo- and enantioselectivity across a broad substrate scope. Central to this selectivity is a chiral spiro phosphine–oxazoline ligand, which imparts precise chemo-, regio-, and stereocontrol through dual CH−π interactions. This strategy streamlines synthesis by enabling a convergent three-component assembly, dramatically reducing step count and complexity. Moreover, the method provides general access to all stereoisomers of polyketide motifs, representing a significant advance in asymmetric catalysis.

图 1 2-烯基-4-甲基-5-氧基结构单元及其合成途径的重要性
聚酮类化合物是一类结构多样且具有药理活性的天然产物,由微生物、植物和动物产生。其独特的分子架构—以高密度氧原子、重复的乙酸酯或丙酸酯单元以及多个连续手性中心为特征—赋予了广泛的生物活性,包括抗生素、抗真菌和抗癌作用。诸如2-烯基-4-甲基-5-氧基基团等结构单元,以不同氧化或还原形式反复出现在聚酮类骨架中,成为众多药物及临床候选物的核心骨架。因此,高效且具有立体控制的聚酮类结构构建方法至关重要—不仅对全合成至关重要,对类似物生成和机理研究同样关键。然而,赋予强效生物活性的结构复杂性也使聚酮化合物的化学合成极具挑战性。
传统聚酮合成方法通常依赖于反复进行的双组分偶联反应,随后进行一系列官能团操作。这些分步方法实现了精确的立体控制,例如使用预制手性有机金属试剂进行的不对称醛缩反应、烯丙基化反应和丙炔基化反应。然而,即使催化不对称变体通常也需要化学计量有机金属亲核试剂(硼、硅、锡或钛基烯丙基试剂)或具有烯丙基亲电试剂的还原剂,从而增加了步骤数和操作复杂性。
此类线性或收敛性策略往往增加反应步骤数、成本及累积收率损失—这些因素限制了可扩展性,阻碍了多样性导向合成。在此背景下,多组分反应(MCR)—通过单次操作整合三个或更多构建单元—提供了极具吸引力的解决方案。对于聚酮类化合物合成而言,理想的多组分反应最大化步骤与氧化还原经济性,最小化纯化与操作步骤,并缩短最长线性序列。若能实现一步形成多重键与手性中心的合成方法,将彻底改变复杂分子的合成策略。然而,在单次催化操作中实现精确的化学选择性、区域选择性、立体异构选择性和对映选择性仍面临重大挑战,尤其对于高官能团化的聚酮类结构单元而言。
作者报道了一种催化性、立体选择性的多组分策略,可一步合成具有卓越收敛性、步骤经济性和立体控制的聚酮类相关骨架。该镍催化过程整合三种基础单元—醛、二烯及有机硼酸—实现高度官能化结构单元的快速组装。核心特征包括:(1)单步形成两个C-C键;(2)构建特定烯烃几何构型;(3)高外消旋选择性与对映选择性下同步生成两个相邻sp³立体中心;(4)通过手性螺环膦-噁唑烷配体实现广选性,可获得所有立体异构体;(5)机理证据揭示关键的CH-π配体-底物相互作用在立体控制中的作用。我们预期本文展示的核心理念—包括二烯连接体作为收敛连接器及配体驱动的CH-π立体控制—将广泛适用于天然产物合成与药物化学领域。
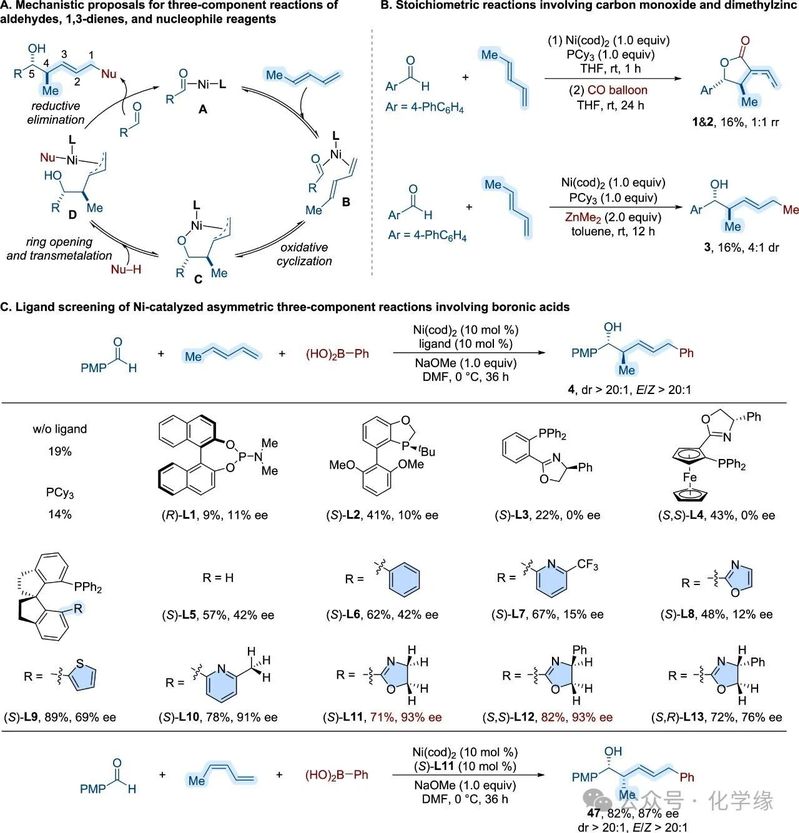
图 2 机理假说、化学计量反应及配体优化
为应对单步构建复杂聚酮结构单元的挑战,提出开发一种以硼酸为亲核偶联试剂的不对称多组分反应。基于Ogoshi等人先前对异戊二烯与苯甲醛与镍(0)形成的烯丙基烷氧基镍(镍环)配合物的研究,构想出本体系的机理路径。该过程始于1,3-戊二烯与镍(0)中心配位(复合物A),形成中间体B,经氧化环化生成镍环C。该中间体作为后续开环反应与亲核试剂转金属化的平台,最终通过还原消除反应形成碳-碳键。作者利用镍(0)催化作用,从1,3-戊二烯和醛类化合物生成活性镍环中间体,从而实现目标2-烯基-4-甲基-5-氧基结构单元的高效一步组装。
随后实施了多组分偶联策略,采用硼酸作为碳基亲核试剂捕获烯丙基烷氧基镍中间体。在不添加配体的情况下,使用Ni(cod)₂预催化剂与对甲氧基苯甲醛、苯硼酸及(E)-1,3-戊二烯反应,以核磁共振收率19%获得了目标产物。评估了一系列手性配体,包括BINOL衍生的磷酰胺酯(L1)、BI-DIME(L2)、PHOX(L3)、Ph-FOXAP(L4)和螺环膦(L5)。
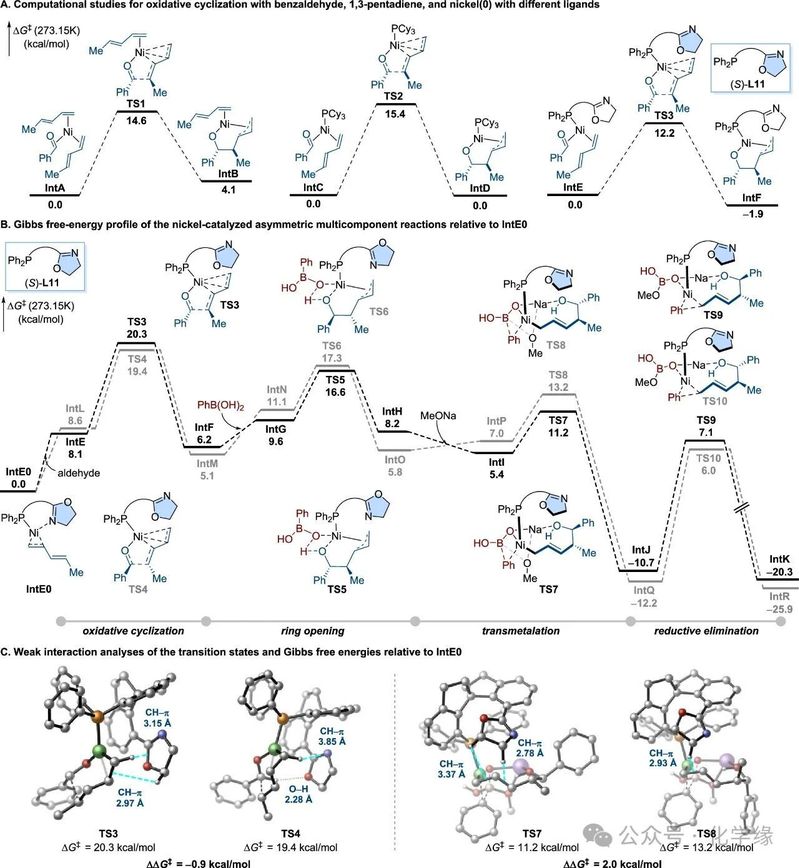
图 3 DFT计算
为探究相关反应机理,针对镍催化下苯甲醛与1,3-戊二烯经不同配体介导的氧化环化反应进行了DFT计算。分析重点聚焦于镍环的形成过程,该过程被确认为镍催化二烯-醛偶联反应的速率决定步骤。通过评估不同配体下的过渡态结构,计算结果显示:1,3-戊二烯作为配体时能量障碍为14.6 kcal/mol,PCy3配体为15.4 kcal/mol,而配体L11呈现显著降低的12.2 kcal/mol障碍值。

图 4 底物范围
该方法实现了2-烯基-4-甲基-5-氧基结构单元的快速构建,具有出色的区域选择性、立体选择性和对映选择性。大量烷基取代的1,3-二烯均能以良好收率生成产物,且具有高顺反选择性和高对映选择性。
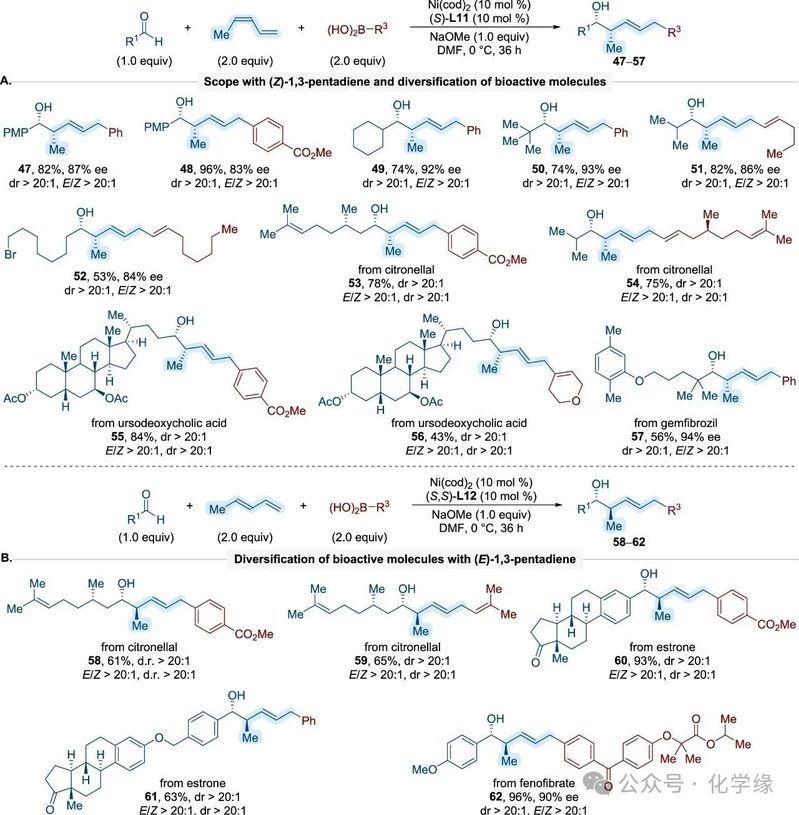
图 5 镍催化多组分反应中(Z)-1,3-戊二烯的应用范围
多种醛类(芳香族与脂肪族)以及各类芳基和烯基硼酸与(Z)-1,3-戊二烯的偶联反应均以高对映选择性生成反式构型产物。该方法在更复杂分子环境中的适用性,将其扩展至结构复杂且具有生物活性的底物。例如,使用对映纯香茅醛或由香茅醛衍生的烯丙基硼酸表明,醛基底物中额外存在的手性中心不会对多组分偶联反应的异构体选择性产生负面影响。此外,成功引入了多种含酮、酯、醚等功能多样化基团的天然产物和药物分子—包括estrone、ursodeoxycholic acid、fenofibrate和gemfibrozil。这些转化以良好至优异的收率和高对映选择性获得了产物。

图 6 衍生化及应用
总结:开发了一种镍催化、对映选择性强的多组分策略,能够从简单易得的试剂高效合成聚酮类骨架。该一步法反应可同时形成两个碳-碳键并构建特定烯烃构型,在广泛的底物范围内生成两个相邻的sp³立体中心,展现出优异的立体选择性和对映选择性。通过采用手性螺环膦-恶唑啉配体,该反应借助双重CH-π相互作用实现了对化学选择性、区域选择性和立体选择性的精确调控,从而突破了单齿配体在不对称催化中长期存在的技术瓶颈。
该方法通过用三组分组装替代传统的两片段偶联策略,简化了聚酮类化合物的构建流程,显著提升了原子和步骤的经济性。值得注意的是,该方法可便捷获得关键聚酮肽结构单元的所有立体异构体,并促进复杂生物活性分子的后期官能团修饰。文中阐述的配体设计原则与多组分收敛概念具有广泛适用性,既为高效构建聚酮肽骨架提供了可靠蓝图,也将推动未来不对称催化方法的发展。
文章信息:
Stereoselective Synthesis of Polyketide Motifs via Nickel-Catalyzed Multicomponent Coupling of Aldehydes, Dienes, and Boronic Acids: Reaction Development and Mechanistic Insights
Jin-Tao Ma#, Bo-Ying Yao#, Tianze Zhang, Shi-Hui Cheng, Bin Xuan, Mengchun Ye, Qi-Lin Zhou, and Li-Jun Xiao*
DOI: 10.1021/jacs.5c17153




