在长期的进化过程中,借助中心法则(DNA→RNA→蛋白质),生命体系合成了种类繁多的碳基生物分子,构建起了结构精密、功能复杂的生命世界。然而,中心法则的固有局限也为生命体系的合成能力划定了边界:其遗传编码体系仅针对碳基生物组分,无法直接实现对无机物的遗传编码与分子水平的原位定点合成,这也成为了生命体系功能拓展的桎梏。
如何突破进化赋予的天然功能限制,在生命体系内实现无机物的位点特异性合成及可遗传标记,从而精准赋予生命体系非碳基特性的超级新功能成为跨学科领域的一大挑战,这不仅需要突破生物遗传系统与无机合成体系的融合难题,还需面对复杂多变的生命体系,解决无机合成的定点定位、可控性及生物相容性等关键问题。
自2009年以来,庞代文研究团队持续深耕无机荧光纳米晶体的活细胞可控合成,成功开创了量子点活细胞合成方法。最近,该团队在Angewandte Chemie International Edition发表了最新研究并被遴选为“Hot paper”。该研究首次在活哺乳动物细胞中实现了功能无机纳米晶体在分子级空间精度上的原位可遗传性定点生长,胞内定点生长的量子点甚至能在病毒天然复制过程中跨物种精准定位到病毒内部深处的蛋白质上。提出了“无机遗传性”概念,即使经过多次细胞传代,量子点依旧可以稳定遗传生长在特定的目标蛋白质上。
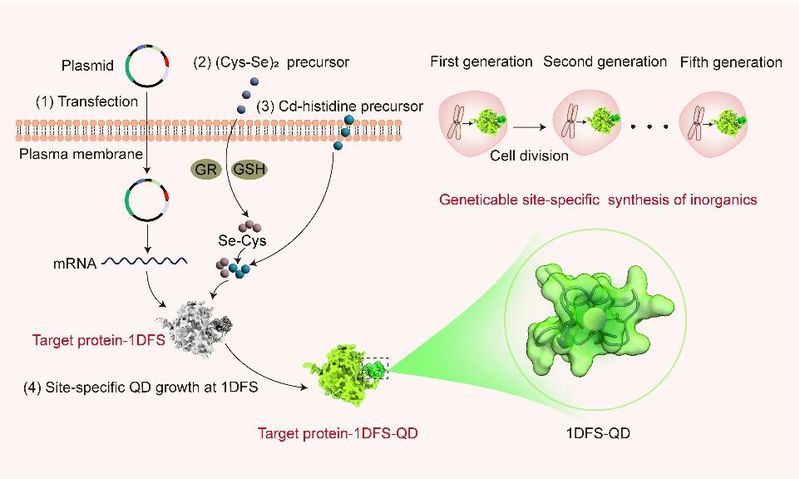
图1. 总体思路。
该研究以“在活细胞内实现无机物的分子级精准可遗传合成”为核心突破,设计了一种富含半胱氨酸的31 肽(1DFS),并通过基因编码技术将其融合到目标蛋白质的特定位点(N 端、C端或功能域),作为定点合成的“分子锚点”,特异性捕获细胞内的Cd2+(Cd2+-组氨酸复合物),再以低氧化活性硒代胱氨酸为原料,利用作者开创的“时空耦合”细胞内从不交会的代谢途径在目标蛋白质特定位点原位合成量子点。
其研究亮点如下:
1. 突破天然局限:开创活细胞内分子级位点特异性无机合成新范式
针对生物中心法则无法编码无机物、传统胞内无机合成随机无序的瓶颈,首次实现了哺乳动物活细胞内量子点的分子特定位点的精准定点合成。通过遗传编码富含半胱氨酸多肽1DFS,将量子点成核与生长严格限定于目标蛋白的特定位点,解决了无机材料与生物体系“定点融合”的核心难题。相较于传统体外合成后靶向递送或胞内随机沉积策略,该方法实现了从“随机不相容”、到“分子位点精准耦合”的跨越。
2. 跨物种拓展:实现病毒粒子功能性精准标记
将胞内无机精准合成跨物种拓展至病毒体系,在流感病毒(H1N1)复制组装过程中,实现量子点对深埋病毒内部核蛋白(NP)的特异性标记,而这是GFP难以做到的。1DFS-NP融合蛋白在宿主细胞内表达后,开启量子点合成,合成的1DFS-NP-QD随病毒天然地复制组装到病毒核糖核蛋白(vRNP)上,最终整合入子代病毒粒子。此荧光标记的病毒仍保留了野生型病毒的感染性,说明病毒结构完整。
3. 实现生命无机稳定遗传
1DFS肽可随目标蛋白的基因表达稳定遗传,即使经过多次细胞传代,定点定位合成的量子点荧光强度仍保持稳定。此外,该肽段分子量仅为传统荧光蛋白的1/10,能最大程度降低对目标生物分子功能的影响,可保证技术的实用性。
4. 可望开辟“无机合成生物学”新方向
该方法具有通用性与可编程性:不仅适用于量子点,还为其他无机纳米材料的胞内位点特异性合成提供了范式,可按需设计融合蛋白,实现不同物种(哺乳动物细胞、病毒等)、不同亚细胞结构(线粒体、内质网等)的精准功能化创造,可望为合成生物学开辟“无机合成生物学”新领域,在生命过程研究、人工细胞工程等领域具有广泛应用前景。
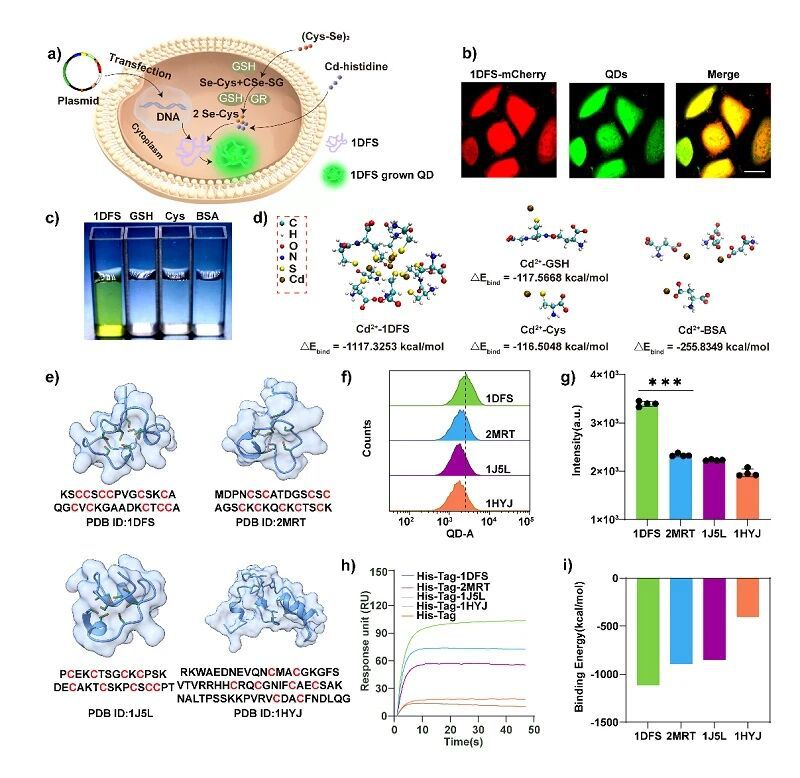
图2. 用于量子点定位合成的 1DFS 肽筛选。(a) 活细胞内1DFS原位定位合成量子点示意图; (b) 表达1DFS 的细胞中量子点合成的代表性共聚焦图像; (c,d) 不同配体存在下的胞外量子点合成及用于解释富含半胱氨酸多肽适配量子点合成的量子化学计算结果; (f,g) 流式细胞术定量分析不同富含半胱氨酸多肽所合成量子点的荧光强度;(h,i) 不同富含半胱氨酸多肽与 Cd2+离子结合亲和力的表面等离子体共振分析及量子化学计算结果。
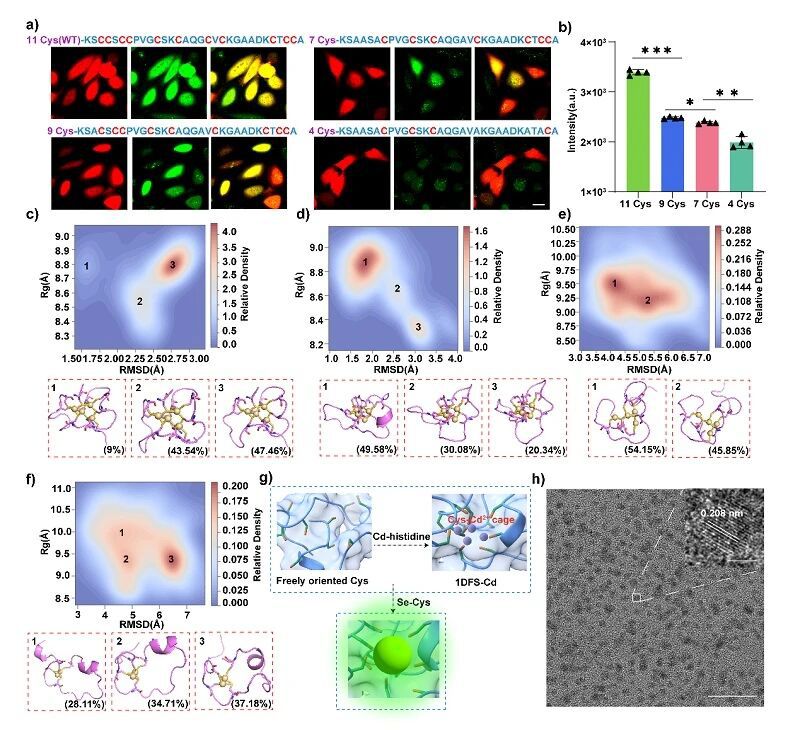
图3. 1DFS 辅助量子点定位合成的机制分析。(a,b) 表达1DFS及其突变体的活细胞中量子点合成的代表性共聚焦成像与流式细胞术分析;(c-f) 1DFS 及其突变体与 Cd2+离子结合的自由能景观分析;(g) 1DFS用于量子点定位合成的机制示意图;(h) 细胞内提取量子点的代表性高分辨透射电子显微镜图像。
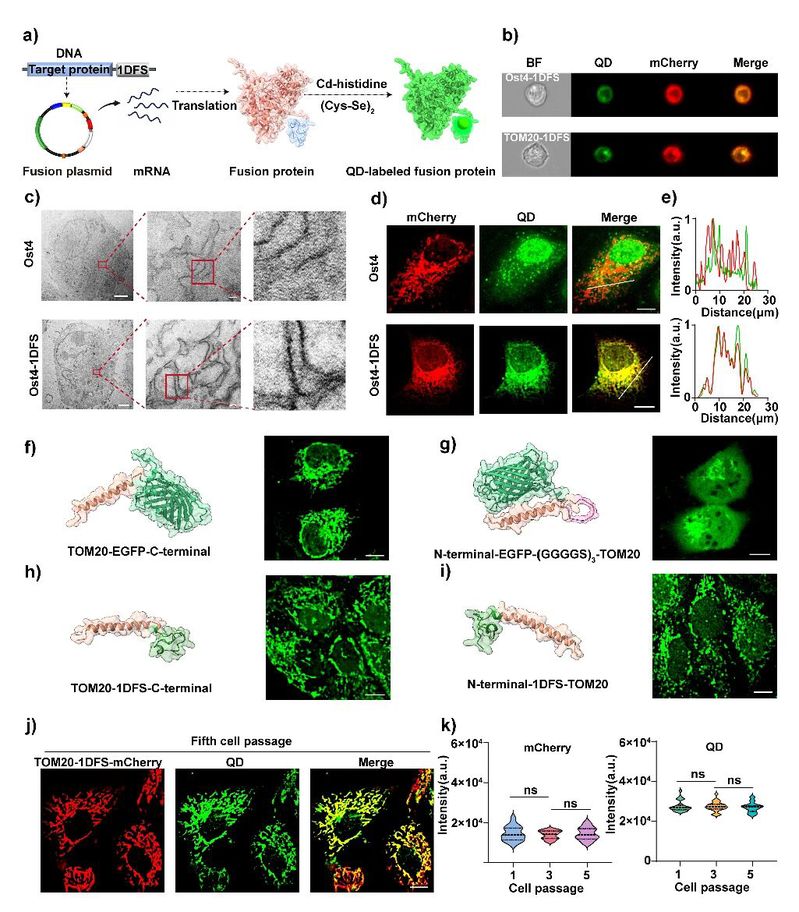
图4. 蛋白标签水平上量子点的空间精准合成。(a) 在特定蛋白质上原位合成量子点的示意图;(b) 表达 TOM20-1DFS-mCherry 或 Ost4-1DFS-mCherry 并原位合成量子点的细胞,其代表性成像流式细胞术图像。TOM20 为线粒体膜蛋白;Ost4 为内质网膜蛋白;mCherry 为红色荧光蛋白;(c-e) 表达 Ost4-mCherry 和 Ost4-1DFS-mCherry 并原位合成量子点的细胞,其透射电子显微镜图像及带共定位分析的代表性共聚焦图像;(f-i) 左图为不同融合蛋白的 AlphaFold3 预测结构;右图为表达对应融合蛋白(增强型绿色荧光蛋白,EGFP标记或原位量子点合成标记)的细胞,其代表性共聚焦图像; (j) 表达 TOM20-1DFS-mCherry 并原位合成量子点的第五代细胞,其代表性共聚焦图像;(k) 在细胞不同传代过程中 mCherry表达的荧光与所原位合成标记的量子点的荧光强度变化。
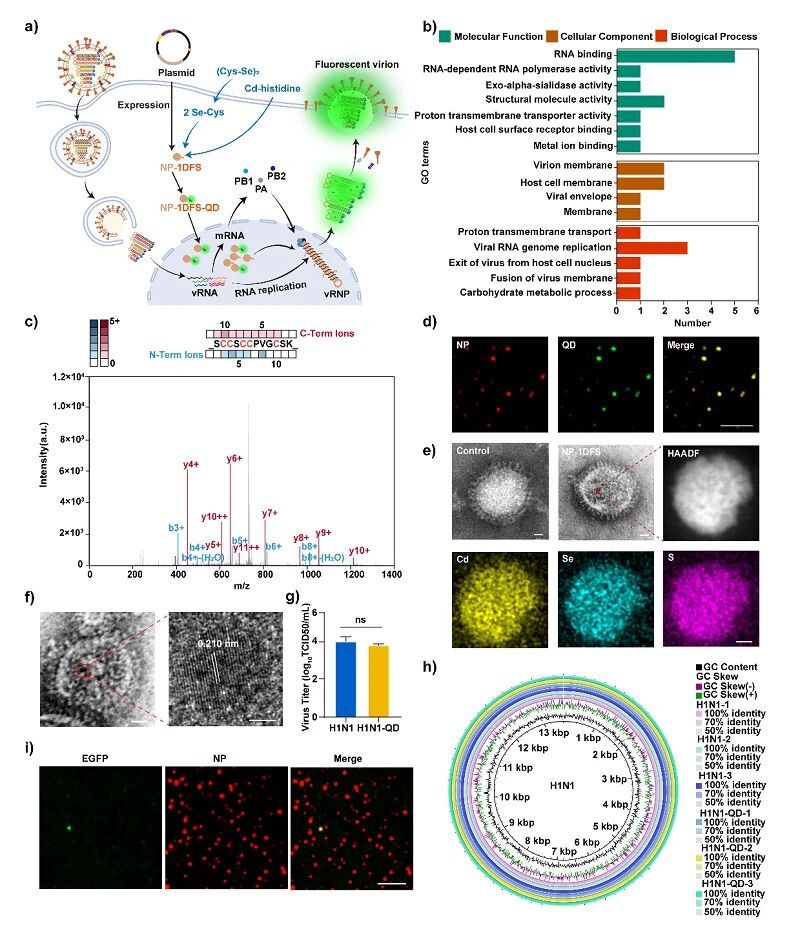
图5. 在病毒宿主细胞内精准调控量子点进入病毒颗粒内部。(a) 量子点发光病毒颗粒形成原理示意图。(b,c) H1N1-量子点病毒颗粒蛋白组分的GO注释及质谱分析; (d,e) H1N1-量子点病毒颗粒的代表性免疫荧光图像及透射电子显微镜元素mapping;(f) 病毒颗粒内量子点的晶格结构。(g,h) 用于探究量子点对病毒颗粒活性影响的半数组织培养感染剂量(TCID₅₀)测定及病毒全基因组测序。 (i) 转染EGFP-NP质粒的宿主细胞中,新增殖子代病毒颗粒的代表性免疫荧光图像。
原文:
Geneticability of Live-Cell Site-Specific Synthesis of Quantum Dots
Qianqian Sun, Hai-Yan Xie, Yusi Hu, Juan Kong, Yi-Fan Wang, Xinran Xu, Jianhong Jia, Zhi-Gang Wang, Shu-Lin Liu, Ling Huang, Dai-Wen Pang
Angew. Chem. Int. Ed., 2025, DOI: 10.1002/anie.202519974




